
【题目】实验测定某硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)样品纯度的过程为:称取1.5000 g样品,配成100 mL溶液。取0.01mol ·L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量的KI。充分反应后,以淀粉作指示剂,用硫代硫酸钠溶液滴定产生的I2,终点时消耗溶液20.00 mL。样品中所含硫代硫酸钠晶体的质量分数为(杂质不参与反应,反应过程中的物质转化关系为K2Cr2O7![]() I2
I2![]() S4O
S4O![]() )
)
A.99.20%B.96.72%C.94.24%D.91.76%
科目:高中化学 来源: 题型:
【题目】(1)有下列物质:①铜;②硫酸钡固体;③氢氧化钠固体;④氨水;⑤溶融硝酸钾;⑥乙醇;⑦液态氯化氢;⑧石墨;⑨二氧化硫;⑩冰醋酸。
其中能导电的有______;属于非电解质的有______;属于强电解质的有______;属于弱电解质的有______。
(2)现有![]() ,
,![]() 的溶液:
的溶液:
①![]() 、②
、②![]() 、③
、③![]() 、④
、④![]() 、⑤
、⑤![]() 、⑥
、⑥![]() 、⑦
、⑦![]() ,
,
其pH由大到小的顺序是![]() 用编号表示
用编号表示![]() ______。
______。
(3)常温下将![]() 溶于水,溶液的pH______
溶于水,溶液的pH______![]() 选填“
选填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,其原因是
,其原因是![]() 用离子方程式或电离方程式表示
用离子方程式或电离方程式表示![]() ______。
______。
(4)已知常温下物质的量浓度相同的三种盐溶液:NaX,NaY,NaZ,它们的pH依次为10、9、8则可知相对应的三种酸HX、HY、HZ的酸性强弱顺序为______。
(5)写出下列盐溶于水发生水解反应的离子方程式:
氯化铝______;
硫化钠______;
醋酸铵______。
(6)现有常温下pH为13的NaOH溶液VmL,要使该溶液的pH降为12,如果加入![]() 的NaOH溶液,需要加入______mL;如果加入和原NaOH溶液同浓度的盐酸溶液,需要加入______
的NaOH溶液,需要加入______mL;如果加入和原NaOH溶液同浓度的盐酸溶液,需要加入______![]() 用含V的代数式表示
用含V的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强 ②混合气体的密度③混合气体的总物质的量 ④混合气体的平均相对分子质量 ⑤混合气体的颜色。
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是______(填序号,下同)。
2SO3(g)达到平衡状态的是______(填序号,下同)。
(2)一定能证明 A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是_______。(注:B、C、D均为无色物质)
C(g)+D(g)达到平衡状态的是_______。(注:B、C、D均为无色物质)
II.某温度时,在一个1L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
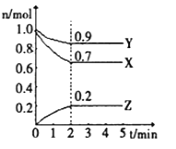
(1)反应开始至2min,以气体Y表示的平均反应速率为________;
(2)该反应的化学方程式为___________;
(3)X的转化率___________,生成的Z的百分含量___________
(4)amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金,被广泛用作有机物的氢化反应的催化剂。以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下图所示:

(1)在形成Ni(CO)4的过程中,碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为___________;
(2)已知红土镍矿煅烧后生成Ni2O3,而加压酸浸后浸出液A中含有Ni2+,写出有关镍元素的加压酸浸的化学反应方程式______________________;
(3)向浸出液A中通入H2S气体,反应的离子方程式是____________________;
(4)“高温熔融”时能否将通入氩气换为CO并说明原因_____________________;
(5)“碱浸”的目的是使镍铝合金产生多孔结构,从而增强对氢气的强吸附性,此过程
中发生反应的离子方程式为___________________。浸出反应所用的NaOH溶液的浓度要大,若NaOH溶液较稀时,则会产生少量的Al(OH)3沉淀而阻止浸出反应的持续进行,请用化学反应原理加以解释:________________________。
(6)浸出液B可以回收,重新生成铝以便循环利用。请设计简单的回收流程:
浸出液B→________________________。(示例:CuOCu2+Cu)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中A为淡黄色固体,B的阳离子与A相同(其他物质均略去).
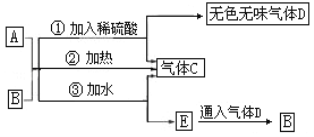
根据以上关系,回答下列问题:
(1)A的电子式为__________.
(2)A投入FeCl2溶液中的反应为_______________(请用一个化学方程式表示)
(3)若A、B按物质的量之比1:1.5混合在密闭容器中加热充分反应后,排出气体,则剩余的固体为_____________________________(写化学式)
(4)氢能被视为21世纪最具发展潜力的清洁能源,试回答下列问题:
①与化石燃料相比,氢气作为燃料的优点是__________________(答两点)。
②施莱辛(Sehlesinger)等人提出可用NaBH4与水反应制氢气,写出NaBH4与水反应的化学方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.打开汽水瓶有气泡从溶液中冒出
B.黄绿色的氯水光照后颜色变浅
C.FeCl3+3KSCN![]() Fe(SCN)3+3KCl平衡体系中加入少量铁粉,溶液颜色变浅
Fe(SCN)3+3KCl平衡体系中加入少量铁粉,溶液颜色变浅
D.2NO2(g)![]() N2O4(g)平衡体系中,加压缩小体积后颜色加深
N2O4(g)平衡体系中,加压缩小体积后颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2在催化剂表面合成氨气反应的能量变化如图,下列说法正确的是
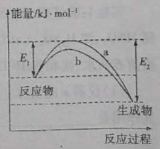
A.相同条件下,催化剂b的效果更好
B.使用催化剂,合成氨反应放出的热量减少
C.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
D.催化剂在吸附N2、H2时,催化剂与气体之间的作用力为化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4 + 5H2C2O4 + 3H2SO4= K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | V1 | 2.7 |
3 | 1.0 | V2 | 2.0 | 3.0 | 3.9 |
请回答:(1)表中V1=___________,V2=___________。
(2)根据上表中的实验数据,可以得到的结论是_____________________________。
(3)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)= ________________________。
(4)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。(忽略反应过程中温度变化)
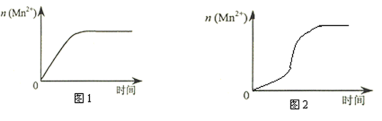
①该小组同学提出的假设是_______________________________________。
②请你帮助该小组同学完成实验方案。
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | A | t |
表中加入的固体A是_______________。(写化学式)
③若该小组同学提出的假设成立,应观察到的现象是____________
(5)工业上可用电解K2MnO4溶液的方法制取KMnO4,则电解时,阳极发生的电极反应式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积固定为2L的密闭容器中充入![]() 和
和![]() ,发生如下反应:①
,发生如下反应:①![]()
![]() ②
②![]() 测得
测得![]() 和
和![]() 的浓度变化如图所示,
的浓度变化如图所示,![]() 维持容器温度为
维持容器温度为![]() ,10min时改变某反应条件,一段时间后再次平衡。下列说法正确的是
,10min时改变某反应条件,一段时间后再次平衡。下列说法正确的是![]()
![]()
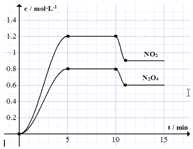
A.前5min反应的平均速率![]()
B.![]() 时反应①的化学平衡常数
时反应①的化学平衡常数![]()
C.10min时改变反应条件可能是降低温度
D.若起始时向该容器中充入![]() 和
和![]() ,
,![]() 达到平衡时,
达到平衡时,![]() 的物质的量浓度与图中
的物质的量浓度与图中![]() 的不同
的不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com