
【题目】短周期主族元素W、X、Y、Z,它们在周期表中位置如图所示,X的一种氢化物与其最高价氧化物对应水化物反应生成盐。下列说法正确的是
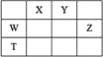
A. X的氢化物的沸点一定低于同主族元素形成的其他氢化物
B. 由Y、Z和氢三种元素形成的化合物中,Z的化合价越高氧化性越强
C. W的氧化物是酸性氧化物,能与碱、水反应,不能与酸反应
D. T元素单质具有半导体的特性,T与Y元素可形成两种化合物TY和![]()
【答案】D
【解析】
N元素形成的氢化物氨气与硝酸可反应生成硝酸铵,则说明X为N,根据元素周期表的位置关系可推出Y、Z、W、T分别是O、Cl、Si与Ge元素,结合元素周期律与物质的性质作答。
根据上述分析可知,X、Y、Z、W、T分别是N、O、Cl、Si与Ge,则
A. X的氢化物为NH3,分子间存在氢键,比同族短周期其他元素的沸点高,A项错误;
B. 氧化性强弱:HClO>HClO2>HClO3,跟含氧酸的元素化合价无直接关系,B项错误;
C.二氧化硅可与氢氧化钠反应,但不与水反应,可与氢氟酸可以发生反应生成四氟化硅与水,C项错误;
D. Ge位于元素周期表的金属与非金属的边界线上,具有半导体的特性,与C同族,C可形成CO与CO2,根据同族元素的相似性可知,其氧化物可以是GeO或GeO2,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】室温时,向20mL 0.1mol/L的CH3COOH溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
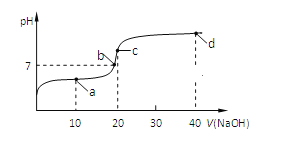
A. a点时:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
B. b点时:c(Na+)<c(CH3COO-)
C. c点时:c(OH-)=c(CH3COOH)+ c(H+)
D. d点时:c(Na+)>c(OH-) > c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度一定的条件下,N2(g)+ 3H2(g)![]() 2NH3(g)在密闭容器中反应并达到平衡时,混合气体的平均摩尔质量为
2NH3(g)在密闭容器中反应并达到平衡时,混合气体的平均摩尔质量为![]() ,N2与NH3的浓度均为c mol·L1。若将容器的体积压缩为原来的1/2,当达到新的平衡时,下列说法中不正确的是
,N2与NH3的浓度均为c mol·L1。若将容器的体积压缩为原来的1/2,当达到新的平衡时,下列说法中不正确的是
A.新的平衡体系中,N2的浓度小于2c mol·L1大于c mol·L1
B.新的平衡体系中,NH3的浓度小于2c mol·L1大于c mol·L1
C.新的平衡体系中,混合体的平均摩尔质量大于![]()
D.新的平衡体系中,气体密度是原平衡体系的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯过氧化氢(H2O2)是淡蓝色的黏稠液体,可与水以任意比混合,水溶液俗称双氧水,为无色透明液体。实验室常用过氧化氢制取氧气,工业上过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)过氧化氢中氧元素的化合价是__。
(2)实验室中用过氧化氢制取氧气的化学方程式为__。
(3)同学们用0.1000mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO![]() +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①在该反应中,H2O2被__(填“氧化”或“还原”);酸性高锰酸钾溶液应装在__(填“酸式”或“碱式”)滴定管中。
②当滴入最后一滴酸性高锰酸钾标准溶液,__即滴定到达终点。
③用移液管吸取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
则试样中过氧化氢的浓度为___mol·L-1。
④若滴定前尖嘴中有气泡,滴定后消失,则测定结果__(填“偏低”、“偏高”或“不变”)。
(4)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲乙两位同学的说法是否正确:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
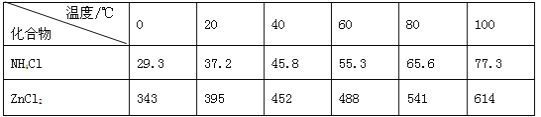
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为 ____。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn__________g。(已经F=96500C/mol)
(3)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,加碱调节至pH为___________时,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱调节至pH为_________时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2)⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有__________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_________。
(4
(5)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式);呈两性的氢氧化物是_________(填物质化学式),该化合物与NaOH溶液反应的离子方程式为___________。
(6)用电子式表示元素③与⑨形成化合物的过程_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多晶硅是单质硅的一种形态,是制造硅抛光片、太阳能电池及高纯硅制晶的主要原料。已知多晶硅第三代工业制取流程如图所示:
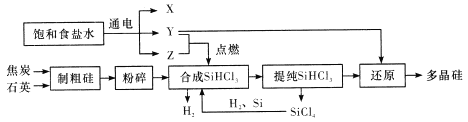
下列说法错误的是
A. Y、Z分别为H2、Cl2
B. 制取粗硅的过程中焦炭与石英会发生副反应生成碳化硅,在该副反应中,氧化剂与还原剂的物质的量之比为1:1
C. SiHCl3极易水解,其完全水解的产物为H2SiO3、H2、HCl,据此推测SiHCl3中硅元素的化合价为+2价
D. Y与SiHCl3制备多晶硅的反应属于置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() 2C(g) ΔH<0,达到平衡时,下列说法正确的是
2C(g) ΔH<0,达到平衡时,下列说法正确的是
A. 加入催化剂,B的转化率增大 B. 减小容器体积,平衡不移动
C. 增大c(A),A的转化率增大 D. 降低温度,v正 增大,v逆 减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用2-溴丙烷制取1,2-丙二醇[(CH3CH(OH)CH2OH)]经过三步。请写出相应的化学方程式,注明反应类型。
(1)___________ 反应类型 ___________
(2)__________ 反应类型 ___________
(3)_________ 反应类型 ____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com