
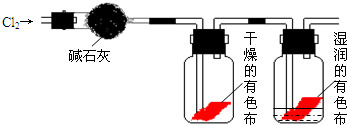

 ,
, ;
;

科目:高中化学 来源: 题型:阅读理解
 “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
| ||
| 2S×7.14 |
| ||
| 2S×7.14 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 Al(OH)3+3H+,Cu2++2H2O
Al(OH)3+3H+,Cu2++2H2O Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑
Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑ Al(OH)3+3H+,Cu2++2H2O
Al(OH)3+3H+,Cu2++2H2O Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑
Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
| A | 正极 | NaOH | Al-3e-=Al3+ | 2H2O+2e-=2OH-+H2↑ |
| B | 负极 | 稀盐酸 | 2Al-6e-=2Al3+ | 6H++6e-=3H2↑ |
| C | 正极 | 浓硝酸 | Cu-2e--=Cu2+ | 2NO3-+4H+-4e-=2NO2↑+2H2O |
| D | 负极 | 稀硝酸 | Cu-2e-=Cu2+ | 2NO3-+8H+=2NO↑+4H2O+6e- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 溶解度(g/100水) | 物质 | 溶解度(g/100水) |
| Ca(OH)2 | 0.173 | Ba(OH)2 | 3.89 |
| CaCO3 | 0.0013 | BaSO3 | 0.016 |
| Ca(HCO3)2 | 16.60 |
| 实验方案 | 现象 |
| 1.取少量溶液于试管中,加入稀盐酸,加热, 用湿润的蓝色石蕊试纸检验生成的气体. |
|
| 2.取少量溶液于试管中,加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为了从含有 FeCl3、FeC12、CuC12 的废液中回收Cu,某研究性学习小组的同们设计了两种方案:
方案1 :向废液中加入过量的铁粉,充分反应后,过滤。 在所得滤渣中加入足量的盐酸,充分反后,再过滤即得到铜。
方案1中涉及的四种阳离子的氧化牲由强到弱的顺序为:_____________________过滤操作时,需要用到的玻璃仪器是:______________________
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出。
方案2中铜作______极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)_______________________________________________________ 另一电极所发生的电极反应为_____________________________ 方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为: ______________________
查看答案和解析>>
科目:高中化学 来源: 题型:

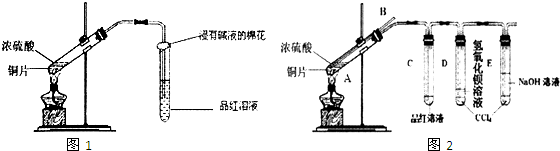
(1)简述该装置气密性的检验方法:_________________________________________________。
(2)滴加硫酸和浓NaOH溶液的顺序是______________________________________________。
(3)实验过程中长胶头滴管外缠绕的滤纸片的变化现象是______________________________。
(4)A瓶中盛放的试剂是__________________________________________________________。
(5)B瓶的作用是_________________________________________________________________。
(6)有同学说,该实验不能完全到达实验目的,其理由是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com