
【题目】用钠镁铝分别与盐酸反应填写下面几种情况的空白:
(1)称取相同质量的钠镁铝,然后分别与足量盐酸反应,则产生的氢气在通常条件下的体积之比为_____________。
(2)取相同物质的量的钠镁铝,分别与足量盐酸反应,则产生氢气质量之比为_________。
(3)如果要制取相同体积的氢气(同温同压下),与足量的盐酸分别反应时所消耗的钠镁铝的物质的量之比为___________。
【答案】(1)(1/23):(1/12):(1/9) (2)1:2:3 (3)6:3:2
【解析】
试题分析:(1)金属完全反应,令质量为1g,则Na、Mg、Al的物质的量之比为![]() ,根据电子转移守恒,生成氢气物质的量之比为
,根据电子转移守恒,生成氢气物质的量之比为![]() ,则相同条件下生成氢气体积之比为
,则相同条件下生成氢气体积之比为![]() ;
;
(2)金属完全反应,令金属的物质的量为1mol,根据电子转移守恒,生成氢气的物质的量之比为1mol×1:1mol×2:1mol×3=1:2:3,则生成氢气质量之比为1:2:3;
(3)相同条件下生成氢气体积相等,则氢气的物质的量相等,令氢气的物质的量为1mol,根据电子转移守恒,需要Na的物质的量=![]() =2mol,Mg的物质的量=
=2mol,Mg的物质的量=![]() =1mol,Al的物质的量=
=1mol,Al的物质的量=![]() mol,故需要Na、Mg、Al的物质的量之比=2mol:1mol:2/3mol=6:3:2,Na、Mg、Al的质量之比=2mol×23g/mol:1mol×24g/mol:2/3mol×27g/mol=23:12:9。
mol,故需要Na、Mg、Al的物质的量之比=2mol:1mol:2/3mol=6:3:2,Na、Mg、Al的质量之比=2mol×23g/mol:1mol×24g/mol:2/3mol×27g/mol=23:12:9。


科目:高中化学 来源: 题型:
【题目】(1)200 ℃时,11.6 g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6 g,则原混合物的平均相对分子质量为 ;
(2)为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是 ;
(3)将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。请画出加入盐酸的体积和生成CO2的物质的量的关系的图像。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了更好的解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻我新能源。以下做法不能提高燃料效率的是( )
A. 煤的汽化与液化 B. 液体燃料呈雾状喷出
C. 通人大大过量的空气 D. 将煤粉碎后燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】化合物A里一种重要的原料,其结构简式为![]() ,可由化合物甲生成。其转化关系及相应反应如下:
,可由化合物甲生成。其转化关系及相应反应如下:

已知:①甲的分子式为C18H17ClO2;
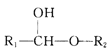
②R1-CHO+R2-OH![]()
回答下列问题:
(1)A的化学名称为____________;A分子中最多有_________个碳原子处于同一平面上。
(2)C→F的反应类型为___________;F中含氧管能团名称为______________。
(3)化合物甲反应生成A、B的化学方程式为_________________。
(4)A有多种同分异构体,其中符合下列条件:①能与溴发生加成反应;②分子中含苯环,且在 NaOH溶液中发生水解反应;③核磁共振氢进有5组峰,且面积比为1:2:2:1:2的是__________
(写结构简式;立体异构中有一种形式为顺反异构,当相同原子或基团在双键平面同一侧时为顺式结构,在异侧时为反式结构,则A的顺式结构简式为___________。
(5)![]() 是重要的有机合成工业中间体之一,广泛用于医药、香料、塑料和感 光树脂等化工产品,参照上述反应路线,设计一条以A为原料合成
是重要的有机合成工业中间体之一,广泛用于医药、香料、塑料和感 光树脂等化工产品,参照上述反应路线,设计一条以A为原料合成![]() 的路线(其他试剂任选):
的路线(其他试剂任选):
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一同学欲从量筒中取出部分液体,他先俯视凹液面的最低处,读数为50mL,倒出液体后,他又仰视凹液面的最低处,读数为10mL他实际倒出液体的体积为( )
A.40mL
B.大于40mL
C.小于40mL
D.不一定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
I.脱硝:已知:H2的热值为142.9 kJ/g(热值是表示单位质量的燃料完全燃烧时所放出的热量);
N2(g) + 2O2(g)= 2NO2(g) △H= +133 kJ/mol
H2O(g) =H2O(l) △H=- 44 kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为_____________。
Ⅱ.脱碳:向2L密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l)。
CH3OH(l) + H2O(l)。
(1)①该反应自发进行的条件是___________(填“低温”“高温”或“任意温度”)。
②下列叙述能说明此反应达到平衡状态的是___________。
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
e.1 mol CO2生成的同时有3 mol H—H键断裂
③CO2的浓度随时间(0~t2)的变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6的浓度随时间的变化。

(2)改变温度,使反应CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g) △H<0中的所有物质都为气态。起始温度体积相同(T1℃、2L.密闭容器)。反应过程中部分数据见下表:
CH3OH(g) + H2O(g) △H<0中的所有物质都为气态。起始温度体积相同(T1℃、2L.密闭容器)。反应过程中部分数据见下表:
反应时间 | CO2 (mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应I 恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应II绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
①达到平衡时,反应I、II对比:平衡常数K( I ) __________K(II)(填“>”“<”或“=”,下同);平衡时CH3OH的浓度c(I)___ ________c(II)。
②对反应I,前10 min内的平均反应速率v(CH3OH) =____________,在其他条件不变下,若30 min时只改变温度为T2℃,此时H2的物质的量为3.2 mol,则T1_________T2(填填“>”“<”或“=”)。若30 min时只向容器中再充入1 mol CO2(g)和1mol H2O(g),则平衡 ______________移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 用烧杯可以精确配制0.1 mol·L-1的NaOH溶液
B. 用淀粉溶液检验某溶液中是否存在碘单质
C. 可利用丁达尔效应区分胶体与溶液
D. 用苯可以萃取溴水中的溴单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com