
【题目】(1)200 ℃时,11.6 g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6 g,则原混合物的平均相对分子质量为 ;
(2)为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是 ;
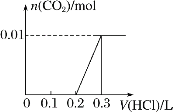
(3)将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。请画出加入盐酸的体积和生成CO2的物质的量的关系的图像。
【答案】(1)23.2 (2)![]()
(3)
【解析】
试题分析:(1)200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,氧气的物质的量为:n(O2)=8g÷32g/mol=0.25mol,
根据方程式2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑可知:n(混合气体)=2n(O2)=2×0.25mol=0.5mol,所以原混合气体的平均摩尔质量为:11.6g÷0.5mol=23.2g/mol,故混合气体的平均相对分子质量为23.2。
(2)设样品中含有NaHCO3杂质的质量为x,则
2NaHCO3![]() Na2CO3+CO2↑+H2O质量减少△m
Na2CO3+CO2↑+H2O质量减少△m
2×84 106 62
x (w1g-w2g)
所以2×84:62=x:(w1g-w2g)
解得x=![]() g,
g,
则w(Na2CO3)=1-![]() =
=![]() ;
;
(3)将0.4gNaOH的物质的量为:0.01mol,1.06gNa2CO3的物质的量为:0.01mol,向溶液中滴加0.1molL-1稀盐酸,首先是盐酸与氢氧化钠反应生成氯化钠与水,消耗盐酸的体积为:0.01mol÷1mol/L=0.1L,继续滴加时,盐酸和Na2CO3开始反应,首先发生HCl+Na2CO3=NaHCO3+NaCl,不放出气体,当消耗盐酸为为0.1 L时碳酸钠全部转化为碳酸氢钠;继续滴加时,发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,此时又消耗盐酸的0.1L,图象为: 。
。


科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3molA、0.1molC和一定量B三种气体。一定条件下发生反应,各物质浓度随时间变化如图甲所示[t0~t1阶段c(B)未画出]。图乙为t2时刻后改变条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种条件并且所用条件均不相同。已知t3~t4阶段为使用催化剂。下列说法正确的是( )
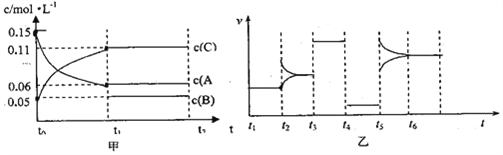
A. 若t1等于15s,生成物C在t0~t1时间段的平均反应速率为0.004mol/(Ls)
B. t4~t5阶段改变的条件为降低反应温度
C. B的起始的物质的量为0.02mol
D. t5~t6阶段可能是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量相等的CO和CO2相比较,下列有关叙述中正确的是
①它们所含的分子数目之比为1∶1
②它们所含的氧原子数目之比为1∶2
③它们所含的原子总数目之比为2∶3
④它们所含的碳原子数目之比为1∶1
A.①④ B.②③ C.①②④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
(1)W2-离子的结构示意图为 ,E元素在周期表中的位置为 ,写出E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式 。
(2)经测定A2W2为二元弱酸,A2W2的电子式为 ,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式 。
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀成.当消耗2mol I﹣时,共转移3mol电子,该反应的离子方程式是 。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,写出该反应方程式 ,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是 L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 工业上用Cl2和石灰水为原料生产漂白粉
B. “霾尘积聚难见路人”,雾霾所形成的气溶胶具有丁达尔效应
C. 氢氧化铁胶体用于饮用水的净化、消毒
D. 将饱和FeCl3溶液滴入NaOH溶液中制备Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于原子结构的叙述中:
①所有原子核均由质子和中子构成;
②原子处于基态时,次外层电子不一定是8个;
③稀有气体元素,其基态原子最外层都是8个电子;
④最外层电子数为2的原子一定是金属原子。
其中正确的是
A.①② B.②③ C.只有② D.只有④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨分子、水分子、甲烷分子中共价键的键角分别为a、b、c,则a、b、c的大小关系为
A. a<b<c B. c<b<a
C. b<c<a D. b<a<c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于平衡常数K与化学平衡移动的关系叙述正确的是( )
A. K值不变,平衡不会移动 B. K值变化,平衡一定移动
C. 平衡移动,K值一定变化 D. 平衡移动,K值一定不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用钠镁铝分别与盐酸反应填写下面几种情况的空白:
(1)称取相同质量的钠镁铝,然后分别与足量盐酸反应,则产生的氢气在通常条件下的体积之比为_____________。
(2)取相同物质的量的钠镁铝,分别与足量盐酸反应,则产生氢气质量之比为_________。
(3)如果要制取相同体积的氢气(同温同压下),与足量的盐酸分别反应时所消耗的钠镁铝的物质的量之比为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com