
【题目】我国研制的第二代“彩虹鱼”万米级深海着陆器所用金属材料主要是钛合金。以钛铁矿(成分:FeTiO3及少量Fe2O3、FeO等杂质)为主要原料制钛的流程如下:

已知:① 钛在常温下不与强酸、强碱反应;② Ti4+易水解生成TiO2+, TiO2+进一步水解可得H2TiO3。
(1) “废气”中含有少量空气污染物,其分子式为________。
(2) “150-200℃溶煮”时生成Ti(SO4)2和TiOSO4且有气体产生,写出生成TiOSO4反应的化学方程式___________________________________。
(3) 沉淀池中加入Fe时,开始无气泡,溶液由棕黄色变浅绿色,片刻后有无色无味气体产生。写出Fe参与的离子反应方程式____________________________。
(4) “加热煮沸”操作的主要目的是_____________。
(5) “精炼” 阶段,从Ti、Mg混合物获得Ti时可以使用的试剂是_______________。
【答案】SO2 2FeTiO3 + 6H2SO4 ![]() Fe2(SO4)3 + SO2↑+ 2TiOSO4 + 6H2O Fe + 2Fe3+= 3Fe2+、Fe + 2H+ = Fe2+ +H2↑ 使反应液升温并充分混合;促进Ti4+、TiO2+水解生成H2TiO3 稀盐酸(或稀硫酸)
Fe2(SO4)3 + SO2↑+ 2TiOSO4 + 6H2O Fe + 2Fe3+= 3Fe2+、Fe + 2H+ = Fe2+ +H2↑ 使反应液升温并充分混合;促进Ti4+、TiO2+水解生成H2TiO3 稀盐酸(或稀硫酸)
【解析】
钛铁矿(成分:FeTiO3及少量Fe2O3、FeO等杂质)加入浓硫酸150-200℃煮沸发生反应:FeTiO3+6H2SO4 ![]() Fe2(SO4)3+SO2↑+2TiOSO4+6H2O,Fe2O3、FeO溶解生成Fe2(SO4)3,得到含有Fe2(SO4)3、TiOSO4的酸性溶液,加入Fe,发生反应:Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,再将溶液蒸发浓缩,冰水浴中冷却,过滤得到FeSO4·7H2O,将滤液调节pH,加热煮沸,使溶液中的TiO2+、Ti4+水解得到H2TiO3,煅烧H2TiO3得到TiO2,加入C和氯气得到TiCl4,加入镁还原得到Ti,其中混有镁,将其投入足量的稀盐酸中反应,过滤、洗涤、干燥得到纯净的Ti。
Fe2(SO4)3+SO2↑+2TiOSO4+6H2O,Fe2O3、FeO溶解生成Fe2(SO4)3,得到含有Fe2(SO4)3、TiOSO4的酸性溶液,加入Fe,发生反应:Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,再将溶液蒸发浓缩,冰水浴中冷却,过滤得到FeSO4·7H2O,将滤液调节pH,加热煮沸,使溶液中的TiO2+、Ti4+水解得到H2TiO3,煅烧H2TiO3得到TiO2,加入C和氯气得到TiCl4,加入镁还原得到Ti,其中混有镁,将其投入足量的稀盐酸中反应,过滤、洗涤、干燥得到纯净的Ti。
(1) 钛铁矿(成分:FeTiO3及少量Fe2O3、FeO等杂质)加入浓硫酸得到废气,“废气”中含有少量空气污染物,根据元素可知为SO2。
(2) “150-200℃溶煮”时生成Ti(SO4)2和TiOSO4且有SO2产生,生成TiOSO4反应的化学方程式2FeTiO3 + 6H2SO4 ![]() Fe2(SO4)3 + SO2↑+ 2TiOSO4 + 6H2O。
Fe2(SO4)3 + SO2↑+ 2TiOSO4 + 6H2O。
(3) 溶煮后的溶液为含有Fe2(SO4)3、TiOSO4的酸性溶液,沉淀池中加入Fe时,开始无气泡,发生反应:Fe+2Fe3+=3Fe2+,故溶液由棕黄色变浅绿色,片刻后有无色无味气体氢气产生,Fe+2H+=Fe2++H2↑;
(4) 根据流程,加热煮沸得到H2TiO3,故加热煮沸的目的是使反应液升温并充分混合,促使溶液中的TiO2+、Ti4+水解得到H2TiO3;。
(5) “精炼”阶段,Ti、Mg混合物中,Mg常温下溶于盐酸,已知:钛在常温下不与强酸、强碱反应,故从Ti、Mg混合物获得Ti的实验方案是:将混合物投入足量的稀盐酸中充分反应后,过滤、洗涤、干燥。故:“精炼” 阶段,从Ti、Mg混合物获得Ti时可以使用的试剂是稀盐酸(或稀硫酸)。


科目:高中化学 来源: 题型:
【题目】常温下,下列说法正确的是
A.c(NH4+)相同的①(NH4)2SO4、②(NH4)2CO3、③(NH4)2Fe(SO4)2、④NH4I溶液,其溶质物质的量浓度大小为④>②>③>①
B.0.2 mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH为1
C.NaHCO3溶液中: c(HCO3-)+ c(CO32-)+ 2c(H2CO3)=c(OH-)
D.浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是通过 Li-CO2 电化学技术实现储能系统和 CO2 固定策略的示意团。储能系统使用的电池组成为钌电极/CO2 饱和 LiClO4-(CH3)2SO(二甲基亚砜)电解液/锂片,下列说法不正确的是
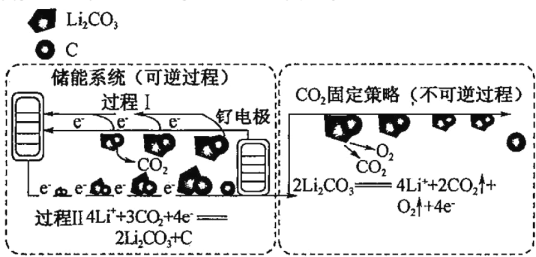
A.Li-CO2 电池电解液为非水溶液
B.CO2 的固定中,转秱 4mole-生成 1mol 气体
C.钌电极上的电极反应式为 2Li2CO3+C - 4e-=4Li++3CO2↑
D.通过储能系统和 CO2 固定策略可将 CO2 转化为固体产物 C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知反应C(s)+H2O(g)CO(g)+H2(g),填写出该反应的平衡常数表达式 K=_____。
(2)写出乙酸电离方程式:_______________________。并写出乙酸电离平衡常数的表达式:K= ____。
(3)用离子方程式表达纯碱溶液为什么可去油污:_____________。
(4)请写CH3COONa溶液的电荷守恒式:__________________________ ,和该溶液各离子浓度从大到小的序列式:___________________________。
(5)写出泡沫灭火器工作原理的离子方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用pH传感器进行数字化实验,分别向两个盛50mL 0.100mol/L 盐酸的烧杯中匀速滴加50mL 去离子水、50mL 0.100mol/L 醋酸铵溶液,滴加过程进行磁力搅拌,测得溶液pH随时间变化如下图所示。已知常温下醋酸铵溶液pH=7,下列说法错误的是

A.曲线X表示盐酸中加水稀释的pH变化
B.曲线Y的pH变化主要是因为CH3COO-与H+结合成了弱电解质
C.a点对应的溶液中c(Cl-)+c(CH3COO-)+c(CH3COOH)-c(NH4+)=0.01mol/L
D.b点对应的溶液中水电离的c(H+)=10-12.86mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将CO2通入2LpH=12的KOH溶液中,溶液中水电离的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如下图所示。下列叙述不正确的是

A.a点溶液中:水电离出的c(H+)=1×10-12mol/L
B.b点溶液中:c(H+)=1×10-7mol/L
C.c点溶液中:c(K+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.d点溶液中:c(K+)=2c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
A.向纯水中加入固体氯化铵,平衡正向移动,pH变小
B.向纯水中加入固体氢氧化钠,平衡逆向移动,pH变小
C.向水中加入少量固体硫酸氢钠,平衡正向移动 , KW不变
D.向水中通入HCl气体,平衡逆向移动,溶液导电能力减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合F是一种重要的有机合成中间体,它的合成路线如下:
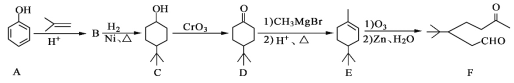
(1)化合物F中含氧官能团的名称是____________和_____________,由B生成C的化学反应类型是_________________________。
(2)写出化合物C与乙酸反应生成酯的化学方程式:________________________。
(3)写出化合物B的结构简式:____________。同时满足下列条件的B的同分异构体(不包括B)共有___________种:能与FeCl3溶液显紫色,苯环上只有两个取代基。
(4)某化合物是D的同分异构体,且核磁共振氢普有三个吸收峰。写出该化合物的结构简式:__________________________________________(任写一种)。
(5)请根据已有知识并结合相关信息,写出以苯酚(![]() )和CH2=CH2为原料制备有机物
)和CH2=CH2为原料制备有机物![]() 的合成路线流程图_____________(无机试剂任用)。
的合成路线流程图_____________(无机试剂任用)。
合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿的要紧成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如图所示。
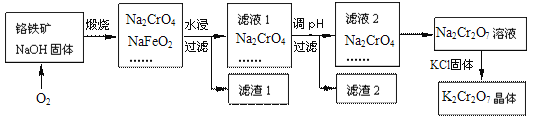
已知:①NaFeO2遇水强烈水解。
②2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
请回答:
(1)K2Cr2O7中Cr元素的化合价是___。
(2)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是___。
(3)滤渣1为红褐色的固体,滤渣1的成分是(填名称)____,滤液1的成分除Na2CrO4、NaOH外,还含有___(填化学式)。
(4)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是___。
(5)写出由滤液2转化为Na2Cr2O7溶液应采取的措施是___。
(6)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、____、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com