
| A.由Fe、Cu与稀硫酸溶液组成的原电池,其负极反应式为:Fe-3e-═Fe3+ |
| B.由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为:Mg-2e-+2OH-═Mg(OH)2 |
| C.由Pb、Cu与氯化铁溶液组成的原电池,其正极反应式为:Cu-2e-═Cu2+ |
| D.由Al、Cu与浓硝酸组成的原电池,其负极反应式为:Cu-2e-═Cu2+ |
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源:不详 题型:单选题
| A.任何化学反应,均可以设计成原电池 |
| B.原电池是把化学能直接转化成电能的装置 |
| C.原电池的两极必须都是金属 |
| D.原电池可以提供持续稳定的电流,应用十分广泛 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝作负极,电池工作时将不断溶解 |
| B.该电池不是二次电池,不可充电 |
| C.碳纤维电极的电极反应是H202+2e-+2H+=2H2O |
| D.电池工作时OH-从碳纤维电极透过离子交换膜移向Al电极 |
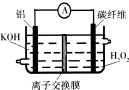
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.炼铜:用黄铜矿(主要成分为CuFeS2)直接电解精炼得到纯度为99.9%的铜 |
| B.制铝:工业上电解氯化铝来制备铝 |
| C.制钠:电解饱和NaCl溶液 |
| D.炼铁:用CO在高温下还原铁矿石中的铁 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.工业上电解熔融AlCl3制取金属铝 |
| B.镁在空气中燃烧的产物只有MgO |
| C.海水提镁和海水提取溴所涉及的化学反应全部是氧化还原反应 |
| D.铜表面形成的铜绿的主要成分为Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在电解池的阴极和原电池的负极上都发生氧化反应 |
| B.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
| C.用惰性电极电解KOH溶液,阴、阳两极产物的物质的量之比为1:2 |
| D.用惰性电极电解饱和NaCl溶液,若有lmol电子转移,则生成l molNaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com