
【题目】按要求填空。
(1)膦(PH3)是一种无色有剧毒的气体,其还原能力比氨(NH3)强,是一种强还原剂.某反应体系中存在下列物质:Cu、H2SO4、CuSO4、PH3、H3PO4、H2O.回答下列问题:
①上述反应体系中化学反应方程式为;
②膦(PH3)能和水发生微弱的化学反应,其水溶液呈弱碱性,该反应可用离子方程式表示为 .
(2)生活污水中含大量细小的悬浮物,可加某些物质使之聚集成较大的颗粒而沉淀.请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为 .
(3)用CH4催化还原NOX可以消除氮氧化物的污染.例如
CH4(g)+4NO2(g) 4NO(g)+CO2 (g)+2H2O(g)△H1=﹣574kJmol﹣1
CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2 , 整个过程中放出的热量为867kJ,则△H2= .
【答案】
(1)PH3+4CuSO4+4H2O=4Cu+H3PO4+4H2SO4;PH3+H2O=PH4++OH﹣
(2)KAl(SO4)2.12H2O
(3)﹣1160kJ/mol
【解析】解:(1)①PH3作还原剂,在反应中失电子生成H3PO4 , 则CuSO4在反应中得电子生成Cu,所以该反应的方程式为PH3+4CuSO4+4H2O=4Cu+H3PO4+4H2SO4 ,
所以答案是:PH3+4CuSO4+4H2O=4Cu+H3PO4+4H2SO4;②PH3 和水电离出的氢离子反应,导致氢氧根离子浓度大于氢离子浓度,溶液呈碱性,离子方程式为:PH3+H2O=PH4++OH﹣ , 所以答案是:PH3+H2O=PH4++OH﹣;
(2.)明矾溶于水后水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附性,所以能净水,明矾的化学式为:KAl(SO4)2.12H2O,所以答案是:KAl(SO4)2.12H2O;
(3.)CH4(g)+4NO2(g)=4NO(g)+CO2 (g)+2H2O(g)△H1=﹣574kJmol﹣1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2 ②,
将方程式①+②得2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O,△H=△H1+△H2
设②中1mol甲烷完全反应放出的热量为x,
2CH4(g) | + | 4NO2(g) | = | 2N2(g) | + | 2CO2(g) | + | 4H2O | △H=△H1+△H2 |
2mol | 574kJ+x | ||||||||
1mol | 867kJ |
x= ![]() =1160kJ,
=1160kJ,
所以△H2=﹣1160kJ/mol,
所以答案是:﹣1160kJ/mol.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一:FeO(s)+CO(g)Fe(s)+CO2(g)不能自发进行,已知正反应吸热.
(l)关于化学反应方向的判据△H﹣T△S<0,反应___________(填能自发、不能自发)
答案:不能自发
(1)该反应中平衡常数的表达式 K═温度升高,化学平衡移动后达到新的平衡,平衡常数K值 . (均填增大、减小或不变)
(2)1100℃时测得高炉中 c(CO2)=0.025mol/L,c(CO)═0.lmol/L,已知1100℃时平衡常数K=0.263.在这种情况下该反应是否处于平衡状态(填是或否),此时化学反应速率是v(正)v(逆)(填=、>或<).
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO,则CO的转化率将(填“增大”、“减小”、“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O的说法正确的是( )
A. Cu是氧化剂
B. 该反应电子转移总数为4e—
C. 硝酸在反应中只体现氧化性
D. NO是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是( )
A.第一块钠失去电子多
B.两块钠失去电子一样多
C.第二块钠的反应产物质量最大
D.第二块钠的反应产物在空气中更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由于物质的漂白性而导致溶液褪色的是( )
①将过氧化钠投入水中,然后加入几滴酚酞溶液,溶液先变红后褪色
②将活性炭放入红墨水中,溶液褪色
③向品红溶液中滴加氯水,红色褪去
④向酸性高锰酸钾溶液中通入二氧化硫气体,溶液紫色褪去
A.①③
B.①②③
C.①②③④
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是产生和收集气体的实验装置,该装置最适合于( )
A.用浓硝酸和Cu反应制取NO2
B.用浓盐酸和MnO2反应制取Cl2
C.用NH4Cl和Ca(OH)2反应制取NH3
D.用H2O2溶液和MnO2反应制取O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了前20号元素中某些元素性质的一些数据:
试回答下列问题:
(1)以上10种元素中,第一电离能最小的是(填编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足8e-稳定结构的物质可能是(写分子式)。元素⑨和⑩形成的化合物的化学式为;元素①的原子价电子排布式是。
(3)①、⑥、⑦、⑩四种元素的气态氢化物的稳定性,由强到弱的顺序是(填化学式)。
(4)③和⑨两元素比较,非金属性较弱的是(填名称),可以验证你的结论的是下列中的(填序号)。
A.气态氢化物的挥发性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表③和⑨两元素)
F.两单质在自然界中的存在形式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某晶体(结晶水合物)由五种短周期元素组成.常温下,将该晶体溶于蒸馏水后可电离出三种离子(忽略水的电离),其中两种离子含有的电子数均为10个.将该溶液分成等量2份,一份中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,产生白色沉淀;向另一份中逐滴加入NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示. 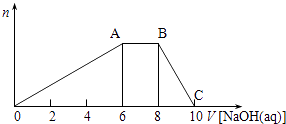
请回答下列问题:
(1)若该晶体的摩尔质量为906gmol﹣1 , 写出该晶体的化学式;
(2)B点溶液的pH7(填“<”、“>”或“=”),用化学用语表示其原因 .
(3)若向该晶体的水溶液中逐滴加入Ba(OH)2溶液至产生最多的沉淀,写出该变化的离子方程式 .
(4)C点溶液中所含溶质的化学式为;此时溶液中各种离子浓度由大到小顺序为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com