
【题目】某晶体(结晶水合物)由五种短周期元素组成.常温下,将该晶体溶于蒸馏水后可电离出三种离子(忽略水的电离),其中两种离子含有的电子数均为10个.将该溶液分成等量2份,一份中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,产生白色沉淀;向另一份中逐滴加入NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示. 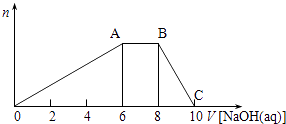
请回答下列问题:
(1)若该晶体的摩尔质量为906gmol﹣1 , 写出该晶体的化学式;
(2)B点溶液的pH7(填“<”、“>”或“=”),用化学用语表示其原因 .
(3)若向该晶体的水溶液中逐滴加入Ba(OH)2溶液至产生最多的沉淀,写出该变化的离子方程式 .
(4)C点溶液中所含溶质的化学式为;此时溶液中各种离子浓度由大到小顺序为 .
【答案】
(1)(NH4)2SO4?Al2(SO4)3?24H2O
(2)>;NH3?H2O?NH4++OH﹣
(3)NH4++Al3++2SO42﹣+2Ba2++4OH﹣=NH3?H2O+Al(OH)3↓+BaSO4↓
(4)Na2SO4、NaAlO2、NH3?H2O;c(Na+)>c(SO42﹣)>c(AlO2﹣)>c(OH﹣)>c(NH4+)>c(H+)
【解析】解:加入BaCl2溶液,说明溶液中有硫酸根离子,由图象随氢氧化钠的加入沉淀量先增加,后减少,而A→B沉淀量不变,说明铵根离子与氢氧根结合生成一水合氨,所以晶体是硫酸铝铵的结晶水合物,而O→A消耗氢氧化钠的体积是6,而A→B,消耗氢氧化钠是2,所以晶体组成中铵根离子与铝之比为:1;1,
(1.)硫酸铝铵的结晶水合物的化学式为(NH4)2SO4Al2 (SO4)3xH2O,得x= ![]() =24,所以晶体的化学式为:(NH4)2SO4Al2 (SO4)324H2O;故答案为:(NH4)2SO4Al2 (SO4)324H2O;
=24,所以晶体的化学式为:(NH4)2SO4Al2 (SO4)324H2O;故答案为:(NH4)2SO4Al2 (SO4)324H2O;
(2.)B点的溶质为硫酸钠和一水合氨,以氨水的电离为主,溶液呈碱性,氨水电离的方程式为:NH3H2ONH4++OH﹣ , 故答案为:>;NH3H2ONH4++OH﹣;
(3.)产生最多的沉淀,也就是硫酸根离子完全沉淀,所以离子方程式为:NH4++Al3++2SO42﹣+2Ba2++4OH﹣=NH3H2O+Al(OH)3↓+BaSO4↓,故答案为:NH4++Al3++2SO42﹣+2Ba2++4OH﹣=NH3H2O+Al(OH)3↓+BaSO4↓;
(4.)B→C,发生氢氧化铝溶解,所以C点的溶质为:Na2SO4、NaAlO2、NH3H2O,此时溶液呈碱性,一水合氨的电离大于偏铝酸盐的水解,而一水合氨电离产生的氢氧根离子对偏铝酸根离子的水解起抑制作用,所以离子浓度大小的顺序为:c(Na+)>c(SO42﹣)>c(AlO2﹣)>c(OH﹣)>c(NH4+)>c(H+),故答案为:c(Na+)>c(SO42﹣)>c(AlO2﹣)>c(OH﹣)>c(NH4+)>c(H+).
一份中加入足量稀盐酸,无明显现象,再加入BaCl2溶液,说明溶液中有硫酸根离子,由图象随氢氧化钠的加入沉淀量先增加,后减少,而A→B沉淀量不变,说明铵根离子与氢氧根结合生成一水合氨,所以晶体是硫酸铝铵的结晶水合物,而O→A消耗氢氧化钠的体积是6,而A→B,消耗氢氧化钠是2,所以晶体组成中铵根离子与铝之比为:1;1,(1)硫酸铝铵的结晶水合物的化学式为(NH4)2SO4Al2 (SO4)3xH2O,求出x的值;(2)B点的溶质为硫酸钠和一水合氨,以氨水的电离为主,溶液呈碱性;(3)产生最多的沉淀,也就是硫酸根离子完全沉淀,所以离子方程式为:NH4++Al3++2SO42﹣+2Ba2++4OH﹣=NH3H2O+Al(OH)3↓+BaSO4↓;(4)B→C,发生氢氧化铝溶解,所以C点的溶质为:Na2SO4、NaAlO2、NH3H2O,此时溶液呈碱性,结合各离子的物质的量分析离子浓度的大小.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)膦(PH3)是一种无色有剧毒的气体,其还原能力比氨(NH3)强,是一种强还原剂.某反应体系中存在下列物质:Cu、H2SO4、CuSO4、PH3、H3PO4、H2O.回答下列问题:
①上述反应体系中化学反应方程式为;
②膦(PH3)能和水发生微弱的化学反应,其水溶液呈弱碱性,该反应可用离子方程式表示为 .
(2)生活污水中含大量细小的悬浮物,可加某些物质使之聚集成较大的颗粒而沉淀.请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为 .
(3)用CH4催化还原NOX可以消除氮氧化物的污染.例如
CH4(g)+4NO2(g) 4NO(g)+CO2 (g)+2H2O(g)△H1=﹣574kJmol﹣1
CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2 , 整个过程中放出的热量为867kJ,则△H2= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法能达到实验目的是( )
A.用分液漏斗从食醋中分离出乙酸
B.用焰色反应鉴别Na2SO4和Na2CO3
C.用NaOH溶液除去Cl2中含有的少量HCl
D.用KSCN溶液检验FeCl3溶液 中是否含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①镧系合金是稀土系储氢合金的典型代表,由荷兰菲利浦实验室首先研制出来。它的最大优点是容易活化,其晶胞结构如图所示。 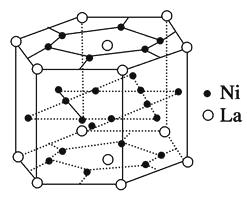
它的化学式为。
②镁系合金是最早问世的合金之一,经X射线衍射实验分析得镁铜合金为面心立方结构,镁镍合金为六方最密堆积。镁系合金的优点是价格较低,缺点是要加热到250℃以上时才释放出氢气。下列有关说法不正确的是
A.金属铜的晶胞结构为 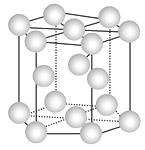
B.已知钛和镁的堆积方式相同,均为六方最密堆积,则其堆积方式为 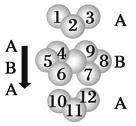
C.镁铜合金晶体的原子空间利用率为74%
D.镁镍合金晶体的配位数为12
③《X射线金相学》中记载关于铜与金可形成两种有序的金属互化物,其结构如图。下列有关说法正确的是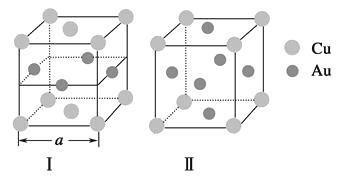
A.图Ⅰ、Ⅱ中物质的化学式相同
B.图Ⅱ中物质的化学式为CuAu3
C.图Ⅱ中与每个铜原子紧邻的铜原子有3个
D.设图Ⅰ中晶胞的边长为acm,则图Ⅰ中合金的密度为 ![]() g·cm-3
g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是(填元素符号)。
(2)元素⑧的原子结构示意图是;由①、④、⑥三种元素组成的化合物,其电子式是。
(3)元素②、⑧的气态氢化物的稳定性较强的是(填化学式);元素③、⑨的最高价氧化物对应的水化物的酸性较强的是(填化学式)。
(4)③、④、⑧三种元素的原子半径由大到小的顺序是(填元素符号)。
(5)元素⑤、⑥组成的化合物的化学键类型是。
(6)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应的本质的说法正确的是( )
A.化学反应都有新物质生成
B.化学反应都有能量变化
C.化学反应是旧键断裂新键形成的过程
D.化学反应的发生都需要在一定条件下
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在恒温条件下,将一定量X和Y的混合气体通入一容积为2 L的密闭容器中,X和Y两物质的浓度随时间变化情况如下图。
(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示):。
(2)0~10min化学反应速度V(X)=。
(3)比较Y在0~10min和10~20min时平均反应速率的大小:v(0~10) v(10~20)(填“<”、“>”或“=”),原因是。
(4)a、b、c、d四个点中,表示化学反应处于平衡状态的点是 , 理由是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】存在于自然界的植物中,其K1=5.4×10﹣2 , K2=5.4×10﹣5 . 草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.请回答下列问题: 
(1)甲组同学按照图1所示装置,通过实验检验草酸晶体的分解产物.装置C中可观察到的现象是 , 由此可知草酸晶体分解的产物中有 . 装置B的主要作用是 .
(2)乙组同学认为草酸晶体分解产物中还有CO,为进行验证,选用甲组实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验. 
① 乙组同学的实验装置中,依次连接的合理顺序为A、B、 . 装置H反应管中盛有的物质是 .
②能证明草酸晶体分解产物中有CO的现象是 .
(3)设计实验证明: ①草酸的酸性比碳酸的强 .
②草酸为二元酸 .
(4)草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4溶液、MnO2氧化,锰元素被还原为+2价.KMnO4溶液和草酸钠溶液在稀硫酸中反应的离子方程式为: . 实验室常用固体草酸钠测定KMnO4溶液的浓度.准确称取0.2000g草酸钠,放入锥形瓶中,加入100mL稀硫酸溶解,用配制好的KMnO4溶液滴定,三次重复实验消耗KMnO4溶液的体积分别是16.02mL、16.00mL、16.01mL,则KMnO4溶液的物质的量浓度的计算式是:c(KMnO4)= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com