
����Ŀ��25��ʱ���й����ʵĵ���ƽ�ⳣ�����£�
��ѧʽ | CH3COOH | H2CO3 | H2SO3 |
����ƽ�ⳣ��K | K=1.8��10-5 | K1=4.3��10-7 K2=5.6��10-11 | K1=1.5��10-2 K2=1.02��10-7 |
��1���������ֵ���ʵ�������ǿ����˳��Ϊ__________________(�û�ѧʽ��ʾ����ͬ)��
��2�������£�0.02 mol��L��1��CH3COOH��Һ�ĵ����ԼΪ______�����Ϊ10mLpH=2�Ĵ�����Һ����������Һ�ֱ������ˮϡ����1000mL��ϡ�ͺ���Һ��pH��ǰ��________����(������������=��)��
��3����֪NaHSO3��Һ�����ԣ���ԭ����____________(���ӷ���ʽ���ʵ���������)��
��4��H2SO3��Һ��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽΪ_______________________��
���𰸡�H2SO3>CH3COOH> H2CO3 3% < HSO3-H++SO3-��HSO3-+H2OH2SO3+OH-��HSO3-�ĵ���̶ȴ���ˮ��̶ȣ�����NaHSO3��Һ������ H2SO3 +HCO3-= HSO3-+CO2��+H2O
��������
(1)�����ݵ���ƽ�ⳣ��KԽ������������Խǿ���
(2)�����ݵ���ƽ�ⳣ��������ȱ���ʽ���м��㣻����Խ����ϡ����ͬ����ʱpH�仯ԽС��
(3)���������ʽ���Ȼ����Ҳ��ˮ�⣬����ҺΪ����ʱ��˵������̶ȴ���ˮ��̶ȣ�
(4)������ǿ�������
(1)������ƽ�ⳣ��KԽ������������Խǿ���ɱ������ݿ�֪�����ֵ����������ǿ������˳��Ϊ��H2SO3>CH3COOH> H2CO3��
�ʴ�ΪH2SO3>CH3COOH> H2CO3��
(2)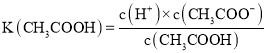 ��c( H+)=c(CH3COO-)��������Һ��c( H+)=c(CH3COO-)=
��c( H+)=c(CH3COO-)��������Һ��c( H+)=c(CH3COO-)=![]() �����Ե����Ϊ
�����Ե����Ϊ![]() ����ˮϡ�Ϳ��Դٽ�������ʵĵ��룬ϡ�ͺ�pH�����������Խ������ϡ�ͺ�pH�ı仯����ԽС��CH3COOH��Ϊ�������������H2SO3��������ͬpH�Ĵ�����Һ����������Һϡ�͵���ͬ���������ҺpH���������С����������ҺpH��������ȣ�������Һϡ�ͺ��pHǰ��С�ں��ߣ�
����ˮϡ�Ϳ��Դٽ�������ʵĵ��룬ϡ�ͺ�pH�����������Խ������ϡ�ͺ�pH�ı仯����ԽС��CH3COOH��Ϊ�������������H2SO3��������ͬpH�Ĵ�����Һ����������Һϡ�͵���ͬ���������ҺpH���������С����������ҺpH��������ȣ�������Һϡ�ͺ��pHǰ��С�ں��ߣ�
�ʴ�Ϊ3%��<��
(3)��HSO3-����Һ�з���ˮ��͵��룬ˮ�����ӷ���ʽΪHSO3-+H2OH2SO3+OH-�����뷽��ʽΪHSO3-H++SO3-��HSO3-����̶ȴ���ˮ��̶ȣ�����NaHSO3��Һ�����ԣ�
�ʴ�ΪHSO3-H++SO3-��HSO3-+H2OH2SO3+OH-��HSO3-�ĵ���̶ȴ���ˮ��̶ȣ�����NaHSO3��Һ�����ԣ�
(4)��������ǿ����������ԭ����H2SO3��Һ��NaHCO3��Һ��Ӧ����NaHSO3��CO2��H2O����Ӧ�����ӷ���ʽΪ��H2SO3 +HCO3-= HSO3-+CO2��+H2O��
�ʴ�Ϊ: H2SO3 +HCO3-= HSO3-+CO2��+H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ����NaHSO4��Һ�����ԣ�������ʹ�û���(NH4)2SO4��ʹ����������������������CuCl2��Һ����ϡ�����ܽ�CuCl2���壻��NaHS��Һ��c(H2S)��c(S2��)�����Ȼ����Һ��ȥ��������Ʒ�������ߡ������������ˮ���йص������У� ��
A.6��B.5��C.3��D.4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ��غ��Ѱ׳��ĸ���Ʒ��������Ϊԭ����������ء���������狀������������ϣ� ԭ�ϵ��ۺ������ʽϸߡ�����Ҫ�������£�

��1����ӦIǰ����FeSO4��Һ�м���_____������ĸ�����Գ�ȥ��Һ�е�Fe3����
A��п�� | B����м | C��KI��Һ | D��H2 |
��2����ӦI����Ʒ�Ӧ�¶ȵ�35������Ŀ����______________________��
��3����ҵ�����ϳ��ڷ�Ӧ���Ĺ����м���һ�����Ĵ����ܼ�����Ŀ���ǣ�________��
��4����Ӧ���������ڵ������(NH4)2S2O8(���������)�����ʱ���ö��Ե缫������
�����ĵ缫��Ӧ�ɱ�ʾΪ��__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������20 mL 0.1 mol/L HA��Һ����μ���0.1 mol/L NaOH��Һ����pH�仯������ͼ��ʾ(�����¶ȱ仯)������˵���в���ȷ����

A. �����֪HAΪ����
B. �ζ��յ�λ��c��d֮��
C. �ζ���b��ʱ��n(Na+)+ n(H+)��n(OH��)+ n(HA)=0.002 mol
D. �ζ���d��ʱ��c(OH��)��c(Na+)��c(A��) ��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���г��Ͼ���������ӵ�أ����ĸ��������ǽ���﮺�̼�ĸ��ϲ��ϣ�̼��Ϊ����﮵����壩�������Ϊһ���ܴ���Li+�ĸ߷��Ӳ��ϡ���������ӵ�صĵ�ط�ӦʽΪ��
Li + 2Li0.35NiO2![]() 2Li0.5NiO2������˵������ȷ���� �� ��
2Li0.5NiO2������˵������ȷ���� �� ��
A.�ŵ�ʱ�������ĵ缫��Ӧʽ��Li �� e-�� Li+
B.�õ�ز�����ˮ��Һ��Ϊ�����
C.���ʱ��Li0.5NiO2�ȷ���������Ӧ�ַ�����ԭ��Ӧ
D.�ŵ������Li+���ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Լӵ�ʳ���е�KIO3�����о�������һ�ְ�ɫ��ĩ�������º��ȶ���������������KIO3��һ�ֽ�ǿ������������HI��H2O2�����ã�����ԭΪ�ⵥ�ʡ� ѧ�������ʵ�����ӵ�ʳ���е�Ԫ�صĺ������������£�
a����ȡmg�ӵ��Σ�����������ˮ�ܽ⣻
b����ϡ�����ữ���ټ������KI��Һ��������Ӧ��IO3��+5I��+6H+=3I2+3H2O������Ӧ�����Һ��ˮϡ����100.00 mL��
c��ȡ10.00mL������Һ����ƿ�У��Ե���Ϊָʾ���������ʵ���Ũ��Ϊ3.0molL��1�� Na2S2O3��Һ�ζ�(�ζ�ʱ�ķ�Ӧ����ʽ��I2+2S2O32���T2I��+S4O62��)��
d���ظ�ʵ��2�Σ�����ʵ��ֱ��¼�й��������£�
�ζ����� | ������Һ�����/mL | 1.00��10��3molL��1�� Na2S2O3��Һ�����(mL) | |
�ζ�ǰ�̶� | �ζ���̶� | ||
��һ�� | 10.00 | 2.62 | 22.60 |
�ڶ��� | 10.00 | 7.56 | 30.30 |
������ | 10.00 | 6.22 | 26.24 |
�Իش�
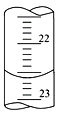
��1������ͼ����ij�εζ�ʱ�ĵζ����е�Һ�棬�����Ϊ___________mL��
��2���жϵ���ζ��յ�������ǣ�_______________________��
��3���ζ�ʱ��Na2S2O3��ҺӦ����______________ (������ʽ�ζ�����������ʽ�ζ�����)��
��4������ʵ��ⶨ���ݣ�����ӵ�ʳ����Ʒ�еĵ�Ԫ�ذٷֺ�����_______(�Ժ�m�Ĵ���ʽ��ʾ)��
��5����������ʵ������мٶ������������,���²������Һ��Ũ����(����ƫС������ƫ����������Ӱ����)
�ٱ�Һ����ʱ�����ζ�ǰ���ӣ��ζ������ӣ��������Һ��Ũ��__________
��ʢ��Һ�ĵζ��ܣ��ζ�ǰ�ζ��ܼ�������ݣ��ζ���������ʧ���������Һ��Ũ��___
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����mgþ�����Ļ�����м���������ϡ���ᣬǡ����ȫ��Ӧ���ɱ�״���µ�����bL����Ӧ�����Һ�м���cmol/L����������ҺVmL��ʹ�������Ӹպó�����ȫ���õ��ij�������Ϊng���ٽ��õ��ij����������������ٸı�Ϊֹ���õ�����pg�������й�ϵ����ȷ����
A. ![]() B.
B. ![]() C. n=m+17Vc D.
C. n=m+17Vc D. ![]() m��p��
m��p��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ѧ�߳ɹ�ʵ���õ�����ˮ����������װ������ͼ��ʾ��
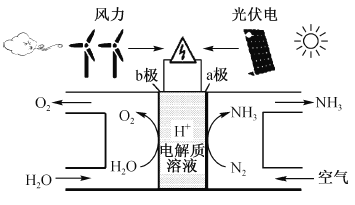
����˵����ȷ����
A. ��ͼ�е�����ת����ʽֻ��2��
B. a�������ĵ缫��ӦΪN2 + 6H�� + 6e�� = 2NH3
C. װ�ù���ʱH�� ��b�����ƶ����������ҺpH��С
D. a������b������������������ʵ���֮��Ϊ1 ��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������[NH4Al(SO4)2��12H2O]�Ƿ�����ѧ���û��Լ������Ʊ��������¡����з�������ȷ���ǣ� ��

A.��������Ӧ��2NH4HCO3��Na2SO4=2NaHCO3����(NH4)2SO4
B.������ҺB�������ӵ��Լ�����BaCl2��Һ
C.��ʡ�Թ���������������������Լ�С
D.���������Һ����μ���NaOH��Һ�����ȣ��Ⱥ�۲쵽���̼��������ݳ�����ɫ������������ɫ������ʧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com