
【题目】以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料, 原料的综合利用率较高。其主要流程如下:

(1)反应I前需在FeSO4溶液中加入_____(填字母),以除去溶液中的Fe3+。
A.锌粉 | B.铁屑 | C.KI溶液 | D.H2 |
(2)反应I需控制反应温度低35℃,其目的是______________________。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是:________。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极
发生的电极反应可表示为:__________________________。
【答案】B 防止NH4HCO3分解(或减少Fe2+的水解 ) 降低K2SO4的溶解度,有利于K2SO4析出 2SO42--2e-=S2O82-
【解析】
(1)Fe3+有氧化性,在除杂时不能引入新的杂质离子,所以可利用其氧化性,向溶液中加入还原铁粉,发生反应:2Fe3++Fe=3Fe2+,达到除杂的目的。该方法比较简单。
(2)如果温度过高会导致NH4HCO3分解,同时由于水解反应是吸热反应,温度越高水解速率越快,也会加快Fe2+的水解,这样会使原料利用率降低。
(3)由题目看出在III反应中生成的K2SO4为固体,而K2SO4在无机溶剂中溶解度比较大,在醇中溶解度较小,所以加入醇类溶剂目的降低K2SO4的溶解度。
(4)根据电解原理,在阳极SO42-失去电子发生氧化反应,电极反应式是:2SO42- -2e-==2S2O82-。


科目:高中化学 来源: 题型:
【题目】物质甲是一种重要的有机化工原料,其结构简式为![]() ,它一般不可能具有的性质是
,它一般不可能具有的性质是
A. 易溶于水,不易溶于有机溶剂
B. 在空气中燃烧产生黑烟
C. 能使溴的四氯化碳溶液褪色
D. 能发生加成反应在一定条件下可与4倍物质的量的氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明溶液中:Ca2+、Cu2+、Br-、Cl-
B. 能使酚酞变红的溶液中:K+、Na+、CO![]() 、AlO2-
、AlO2-
C. c(ClO-)=1mol·L-1的溶液中:Fe2+、Al3+、NO3-、I-
D.  =0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
=0.1mol·L-1的溶液中:NH4+、Mg2+、SO42-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 | H2CO3 |
电离平衡常数(25℃) | K=1.8×10-4 | K=5.1×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 | K1=5.4×10-2 K2=5.4×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
(1)上表的6种酸进行比较,酸性最弱的是:___;HCOO-、S2-、HSO3-3种离子中,最难结合H+的是___。
II.已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=___。
(2)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是__溶液。
(3)各取5mL上述溶液,分别加热到90℃,pH较小的是___溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液___;NH4Cl溶液__。
(5)取5mLNH4Cl溶液,加水稀释至50mL,c(H+)___10-6mol·L-1(填“>”、“<”或“=”),![]() __(填“增大”、“减小”或“不变”)
__(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同分异构体判断正确的是( )
A.二氯甲烷有两种同分异构体
B.分子式为C8H10的芳香烃有3个,分别为 、
、 和
和![]()
C.分子式为C4H8的烯烃同分异构体有2个,分别为CH2=CHCH2CH3、CH3CH=CHCH3
D.分子式为C2H6O的同分异构体有两个,分别是H3C-O-CH3和CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示溶液中发生反应的化学方程式错误的是
A. 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
B. KMnO4+HCOOK+KOH=2K2MnO4+CO2↑+H2O
C. MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D. K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是( )
A. H2SO3的电离方程式:H2SO3![]() 2H++SO32-
2H++SO32-
B. NaHSO4在水溶液中的电离方程式: NaHSO4= Na++H++SO42-
C. Na2CO3的水解∶CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. NH4Cl的水解:NH4++H2O = NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)以上三种电解质的酸性由强至弱顺序为__________________(用化学式表示,下同)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为______,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者________后者(填“>、<或=”)。
(3)已知NaHSO3溶液显酸性,其原因是____________(离子方程式配适当文字叙述)。
(4)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示:
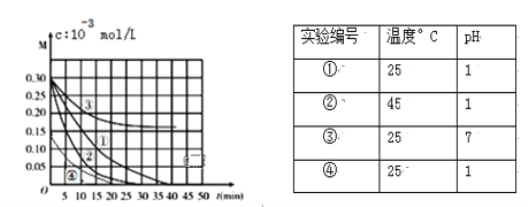
下列说法正确的是
A. 实验①在15 min内M的降解速率为1.33×10-2mol/(L·min)
B. 若其他条件相同,实验①②说明升高温度,M降解速率增大
C. 若其他条件相同,实验①③证明pH越高,越有利于M的降解
D. 实验②④说明M的浓度越小,降解的速率越慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com