

���� ��1��B��Cװ���γ�ԭ��أ�Ǧ��������������Ǧ�������������϶�����Ǧ�õ��Ӻ���������ӷ�Ӧ��������Ǧ��
��2��A���ӵ�Դ����A�ǵ��أ����Pt���������ұ�Cu��������������Cu�ŵ磬�����������ӷŵ磻
��3�����ʱ���Ʋ����������Ƽ����������������Һ�������ӺͶƲ������ͬ��
��4��M���ӵ�Դ������Ϊ��ӵ�Դ��������������
��5������ת�Ƶ����غ������������������
��� �⣺��1��B��Cװ���γ�ԭ��أ�Ǧ��������������Ǧ��������ԭ��طŵ�ʱ�������϶�����Ǧ�õ��Ӻ���������ӷ�Ӧ��������Ǧ��������ԭ��Ӧ���缫��ӦʽΪ��PbO2+2e-+4H++SO42-�TPbSO4+2H2O��
�ʴ�Ϊ��PbO2+2e-+4H++SO42-�TPbSO4+2H2O��
��2��A���ӵ�Դ����A�ǵ��أ����Pt���������ұ�Cu��������������Cu�ŵ磬�����������ӷŵ磬װ��A���ܷ�Ӧ�����ӷ���ʽΪCu+2H+$\frac{\underline{\;ͨ��\;}}{\;}$Cu2++H2����
�ʴ�Ϊ��Cu+2H+$\frac{\underline{\;ͨ��\;}}{\;}$Cu2++H2����
��3����ʱ���Ʋ����������Ƽ����������������Һ�������ӺͶƲ������ͬ����װ��D��Ŀ������ij�Ƽ��϶�������XΪ��������Һ��N��������Ӧ��������
�ʴ�Ϊ��AgNO3�� Ag��
��4��M���ӵ�Դ������Ϊ��ӵ�Դ���������������ʴ�Ϊ����ӵ�Դ��������������
��5����װ��A��Cu�缫�����ı�6.4gʱ��n��Cu��=0.1mol����ת��0.2mol���ӣ�װ��D��n��NaCl��=0.1mol��
�������ȷ���2Cl-2e-=Cl2������η���4OH-4e-=2H2O+O2������������������0.05molCl2���������0.025molO2��
����ֻ����2H++2e-=H2��������0.1molH2�����ܹ�����0.175mol���壬���Ϊ0.175mol��22.4L/mol=3.92L��
�ʴ�Ϊ��3.92L��
���� ���⿼����ԭ��غ͵���ԭ����Ϊ��Ƶ���㣬������ѧ���ķ��������ͼ��������Ŀ��飬��ȷ���ӷŵ�˳���ǽⱾ��ؼ����ѵ��ǵ缫��Ӧʽ����д���Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�������Ͽ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ�����ӷ���ʽ��д��ȷ����
A��ͭ����FeCl3��Һ��3Cu+2Fe3+=3Cu2++2Fe
B��̼������ڴ��CO32��+2H+=CO2��+H2O
C��AlCl3��Һ�м��������ˮ��Al3++3NH3��H2O=Al(OH)3��+3NH4+
D��Ba(OH)2��Һ�м������NaHCO3��Һ��Ba2++HCO3��+OH��=BaCO3��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������ϣ�����һ��ʱ������ɫ��ʧ | |
| B�� | ����������ˮ�У���ˮ��ӽ���ɫ | |
| C�� | ��ϩʹ������Ȼ�̼��Һ��ɫ | |
| D�� | ��ϩʹ���Ը��������Һ��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| t/s | 0 | t1 | t2 | t3 | t4 |
| n��SO3��/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
| A�� | ��Ӧ��ǰt1s��ƽ������v��O2��=0.4/t1mol•L-1•s-1 | |
| B�� | ���������������䣬���ѹ����1.0L��ƽ�ⳣ�������� | |
| C�� | �����¶Ȳ��䣬����������ٳ���0.3 molSO2��0.1molO2��0.2molSO3�����ʱV����V�� | |
| D�� | ��ͬ�¶��£���ʼʱ�������г���4mol SO3���ﵽƽ��ʱ��SO3��ת���ʴ���10% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ŨNaOH��Һ | B�� | ����ʳ��ˮ | C�� | ʯ���� | D�� | Ũ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 5.6gFe��������������ȫ��Ӧʧȥ������Ϊ0.3 NA | |
| B�� | 1.0mol•L��NaCl ��Һ��Na+��ΪNA | |
| C�� | 16gCH4�����ĵ�����Ϊ10NA | |
| D�� | ����£�4.48L��ˮ�к���H2O���ӵ���ĿΪ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
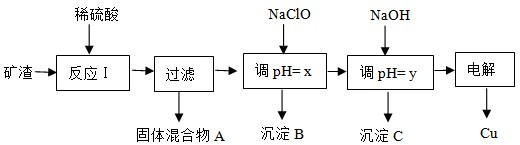
| ���� | Cu��OH��2 | Al��OH��3 | Fe��OH��3 | Fe��OH��2 |
| ��ʼ����pH | 5.4 | 4.0 | 2.2 | 5.8 |
| �������pH | 6.7 | 5.2 | 3.2 | 8.8 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com