
����Ŀ��T��ʱ����2L�����ܱ������г���1mol NO2��2mol SO2�������·�Ӧ��
NO2(g)+SO2(g) SO3(g)+NO(g) ��H=��41.8kJ/mol��
(1)������˵���÷�Ӧ�ﵽƽ��״̬����__________��
a����ϵѹǿ���ֲ���
b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ���
d��ÿ����n mol SO3��ͬʱ����n mol NO2
(2)��Ӧ���е�20s ʱ����÷�Ӧ����v(NO)=0.005mol/(Ls)�������ĵ�NO2Ϊ______mol��
(3)����������Ϊ��������(��������Ƚ���)����ƽ������ʱ�佫_________��
a���ӳ� b������ c������ d����ȷ��
���𰸡�b 0.2 b
��������
(1)���淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ����ʵ��������ʵ���Ũ�ȡ��ٷֺ������ɴ������һϵ�����������䣻
(2)ͬһ���淴Ӧͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ��ݴ˼������������Ӧ���ʣ��ٸ���n=vtV��������������ʵ�����
(3)����������Ϊ��������(��������Ƚ���)���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�������൱�������¶ȣ���Ӧ���ʼӿ졣
(1)a���÷�Ӧ��һ����Ӧǰ�����廯ѧ������֮�Ͳ���Ŀ��淴Ӧ������ѹǿʼ�ղ��䣬������ϵѹǿ���ֲ��䲻��˵���÷�Ӧ�ﵽƽ��״̬����a��ѡ��
b�����������ɫ���ֲ��䣬˵����������Ũ�Ȳ��䣬���Ը÷�Ӧ�ﵽƽ��״̬����bѡ��
c����ʼͶ��NO2��SO2������ƽ�������SO3��NO�������ʼ��Ϊ1:1��SO3��NO������ȱ��ֲ��䲻��˵����Ӧ�ﵽƽ��״̬����c����
d�����۸÷�Ӧ�Ƿ�ﵽƽ��״̬��������ÿ����n mol SO3��ͬʱ����n mol NO2�����Բ��ܾݴ��ж�ƽ��״̬����d��ѡ��
�ʴ�ѡb��
(2)ͬһ���淴Ӧͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ�v(NO2)=v(NO)=0.005molL1s1��v=![]() ��n=vtV�������ĵ�NO2���ʵ���n(NO2)=0.005molL1s1��20s��2L=0.2mol��
��n=vtV�������ĵ�NO2���ʵ���n(NO2)=0.005molL1s1��20s��2L=0.2mol��
(3)����������Ϊ��������(��������Ƚ���)���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�������൱�������¶ȣ���Ӧ���ʼӿ죬�����̷�Ӧ�ﵽƽ��ʱ�䣬��ѡb��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����3�ֲ�ͬ�����£��ֱ����ݻ�Ϊ2L�ĺ����ܱ������г���2molA��1molB��������Ӧ:2A(g)+B(g)![]() 2D(g)��H=QkJ/mol��������������ݼ��±�:
2D(g)��H=QkJ/mol��������������ݼ��±�:
ʵ���� | ʵ��I | ʵ��II | ʵ��III |
��Ӧ�¶�/�� | 700 | 700 | 750 |
��ƽ��ʱ��/min | 40 | 50 | 30 |
n(D)ƽ��/mol | 1.5 | 1.5 | 1 |
��ѧƽ�ⳣ�� | K1 | K2 | K3 |
����˵����ȷ����
A. �����¶��ܼӿ췴Ӧ���ʵ�ԭ���ǽ����˷�Ӧ�Ļ�ܣ�ʹ����Ӱٷ������
B. ʵ��III��ƽ����������������䣬����������ͨ��1molA��1molD��ƽ�ⲻ�ƶ�
C. ʵ��III��ƽ��������ڵ�ѹǿ��ʵ��1��9/10��
D. K3>K2>K1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭƬ����Ƭ��CuSO4��Һ��AgNO3��Һ�����ߺ�����(װ����֬KNO3��U�ι�)����һ��ԭ��ء������йظ�ԭ��ص�������ȷ����(�� ��)

��ͭ�缫���������٢�������ӦΪAg+��e-=Ag���������·�У�������ͭ�缫�������缫����ʵ�������ȡ�����ţ�ԭ����Լ�������
A.�٢�B.�ڢ�C.�ڢ�D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����CO��H2����ȼ�ϼ״�(CH3OH)��һ���������ܱ������з�����Ӧ���������������ͼ��ʾ(��Ӧ����������̬)������˵���������
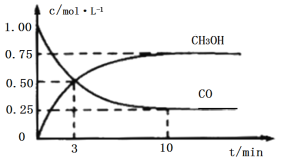
A.��Ӧ�Ļ�ѧ����ʽ��CO+2H2CH3OH
B.��Ӧ������3����ʱ�������淴Ӧ�������
C.��Ӧ��10���ӣ�(CO)=0.075mol/(L��min1)
D.��Ӧ��3���ӣ��ü״�����ʾ��Ӧ��ƽ������Ϊ![]() mol/(L��min1)
mol/(L��min1)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ù����ռ���Һ����ij����(��Al2O3��MgO)�����˺�õ�����Һ�� NaHCO3��Һ�����������Һ��pH��Al(OH)3���ɵ��������NaHCO3��Һ����仯����������ͼ��ʾ�������й�˵���������
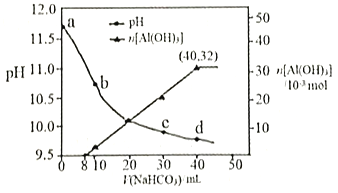
A. a����Һ�д��ڣ�c(Na+)+c(H+)=c(AlO2��)+c(OH��)
B. ˮ�ĵ���̶ȣ�a��С��c��
C. ԭ NaHCO3��Һ��c(H2CO3)+c(HCO3��)+c(CO32��)=0.8mol��L��1
D. ���ɳ��������ӷ���ʽΪHCO3��+AlO2��+H2O=Al(OH)3��+CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���������Һ��ͨ����Ӧ����������ҺpH=7(ͨ���������Һ�����Ӱ��ɺ���)����Һ�в����������ʵ���Ũ�ȹ�ϵ��ȷ����
A.��0.10mol��L-1 NH4HCO3��Һ��ͨCO2��c(![]() )=c(
)=c(![]() )+c(
)+c(![]() )
)
B.��0.10mol��L-1 NaHSO3��Һ��ͨNH3��c (Na+)>c(![]() )>c(
)>c(![]() )
)
C.��0.10mol��L-1 Na2SO3��Һ��ͨSO2��c(Na+)=2[c(![]() )+c(
)+c(![]() )+c(H2SO3)]
)+c(H2SO3)]
D.��0.10mol��L-1 CH3COONa��Һ��ͨHCl��c(Na+)>c(CH3COOH)=c(Cl��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵ���Ҫ���������ʽṹ����ش��������⣺
(1)��֪Ԫ��M���������Ca5(PO4)3F��һ��Ԫ�ء�Ԫ��M����̬ԭ�����ʧȥ��1������5��������������(�������ܣ��÷���I1��I��ʾ)�����ʾ��
I1 | I2 | I3 | I4 | I5 | |
������(kJ/mol) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
Ԫ��M����̬�������ϼ���___________�ۣ����̬ԭ�ӵ����Ų�ʽΪ___________��
(2)������ͭ��Һ�м��������ˮ�����γ�[Cu(NH3)4]SO4����Һ������Һ�������ܽ���ά�ء�
��[Cu(NH3)4]SO4�������ӵ����幹����___________��
�ڳ���Ԫ���⣬[Cu(NH3)4]SO4������Ԫ�صĵ縺����С�����˳��Ϊ___________��
��NF3��NH3�Ŀռ乹����ͬ������ԭ�ӵĹ���ӻ����;�Ϊ___________����NF3������Cu2+�γɻ�ѧ������ԭ����___________��
(3)һ��Hg-Ba-Cu-O���³������ϵľ���(������)��ͼ��ʾ��

�ٸ����ʵĻ�ѧʽΪ___________��
����֪�þ���������Ba2+�ļ��Ϊcpm�������Ba2+�����Hg+��ĿΪ___________�������ߵ���̾���Ϊ___________pm��(�г�����ʽ���ɣ���ͬ)
��������ʵ�Ħ������ΪM�������ӵ�������ֵΪNA����þ�����ܶ�Ϊ___________g��cm��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H3PO4��һ����Ԫ��ǿ�ᡣ25��ʱ��ijŨ��H3PO4��Һ����μ���NaOH��Һ���μӹ����и��ֺ����������ʵ�������������ҺpH�ı仯��������ͼ��ʾ������˵����ȷ����

A. ����2������4�ֱ��ʾ��(HPO42��)����(PO43��)�仯
B. 25��ʱ��H3PO4�ĵ��볣��K1��K2=105.1
C. pH=7.2ʱ����Һ����ˮ�������c(H+)=10��7.2mol/L
D. pH=12.3ʱ����Һ��2c(Na+)=5c(H2PO4��)+5c(HPO42��)+5c(PO43��)+5c(H3PO4)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��X(g)��2Y(g)![]() 2Z(g)����2M(g)
2Z(g)����2M(g)![]() N(g)��P(g)�ֱ����ܱ�������������Ӧ���н��У���Ӧ��֮������Ħ�����ɻ������ܷ���塣��Ӧ��ʼ�ʹﵽƽ��״̬ʱ�й��������ı仯��ͼ��ʾ��
N(g)��P(g)�ֱ����ܱ�������������Ӧ���н��У���Ӧ��֮������Ħ�����ɻ������ܷ���塣��Ӧ��ʼ�ʹﵽƽ��״̬ʱ�й��������ı仯��ͼ��ʾ��

����ƽ�⣨������2.8����ƽ�⣨������2.6����
�����ж���ȷ���ǣ� ��
A.��Ӧ�ٵ�����Ӧ�����ȷ�Ӧ
B.��ƽ��(��)ʱ��X��ת����Ϊ5/6
C.��ƽ��(��)��ƽ��(��)�У�M������������
D.���ڷ�Ӧ�ڣ�ƽ��(��)ʱ��ϵ��ѹǿ�뷴Ӧ��ʼʱ��ϵ��ѹǿ֮��Ϊ10 ��11
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com