
【题目】下列溶液的物质的量浓度的计算正确的是![]()
![]()
A. VL![]() 溶液中含
溶液中含![]() g,溶液中
g,溶液中![]() 是
是![]()
![]()
B. 将100mL![]()
![]() 的NaCl溶液与200mL
的NaCl溶液与200mL![]()
![]() 的NaCl溶液混合
的NaCl溶液混合![]() 忽略溶液体积变化
忽略溶液体积变化![]() ,得到溶液的物质的量浓度为2
,得到溶液的物质的量浓度为2![]()
C. 实验室配制480mL![]()
![]() 的硫酸铜溶液,应选取500mL容量瓶,称取
的硫酸铜溶液,应选取500mL容量瓶,称取![]() g胆矾配成500mL溶液
g胆矾配成500mL溶液
D. 标准状况下,aL![]() 溶于1000g水中,得到的溶液密度为b
溶于1000g水中,得到的溶液密度为b![]() ,则该溶液的物质的量浓度为
,则该溶液的物质的量浓度为![]()
![]()
【答案】C
【解析】根据cB=![]() 计算物质的量浓度和相关物理量。
计算物质的量浓度和相关物理量。
A项,n(Fe3+)=![]() =
=![]() mol,n(Fe3+):n(SO42-)=2:3,n(SO42-)=
mol,n(Fe3+):n(SO42-)=2:3,n(SO42-)=![]() mol,溶液中c(SO42-)=
mol,溶液中c(SO42-)=![]() mol
mol![]() VL=
VL=![]() mol/L,A项错误;B项,混合后所得溶液物质的量浓度为
mol/L,A项错误;B项,混合后所得溶液物质的量浓度为![]() =2.17mol/L,B项错误;C项,根据“大而近”的原则,配制480mL溶液应选用500mL容量瓶,所需胆矾的质量为0.1mol/L
=2.17mol/L,B项错误;C项,根据“大而近”的原则,配制480mL溶液应选用500mL容量瓶,所需胆矾的质量为0.1mol/L![]() 0.5L
0.5L![]() 250g/mol=12.5g,C项正确;D项,n(NH3)=
250g/mol=12.5g,C项正确;D项,n(NH3)=![]() mol,m(溶液)=m(NH3)+m(H2O)=
mol,m(溶液)=m(NH3)+m(H2O)=![]() mol
mol![]() 17g/mol+1000g=(
17g/mol+1000g=(![]() +1000)g,溶液的体积为(
+1000)g,溶液的体积为(![]() +1000)g
+1000)g![]() bg/cm3=
bg/cm3=![]() cm3,溶液物质的量浓度为
cm3,溶液物质的量浓度为![]() mol
mol![]() (
(![]() 10-3)L=
10-3)L=![]() mol/L,D项错误;答案选C。
mol/L,D项错误;答案选C。


科目:高中化学 来源: 题型:
【题目】二甲醚制备两种方法原理如下
第一种方法:丹麦Topspe工艺的合成气一步法,是专门针对天然气原料开发的一项新技术。
①2CH4(g)+O2(g)![]() CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1
第二种方法:二甲醚生产二步法,即先合成甲醇,甲醇在催化剂下制二甲醚。
②CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
③2CH3OH(g)![]() CH3OCH3 (g)+H2O(g) △H3
CH3OCH3 (g)+H2O(g) △H3
(1)若由合成气(CO、H2)直接制备 1molCH3OCH3(g),且生成H2O(1),整个过程中放出的热量为244kJ,则△H2=___________kJ·mol-1。(已知:H2O(1)=H2O(g) △H=+44.0 kJ/mol)
(2)下列有关反应①叙述不正确的是___________
a.达到平衡后,升高温度,ν正减少、ν逆增大,平衡逆向移动
b.当四种物质的浓度相等,反应达到化学平衡状态
c.若改变条件,反应物的转化率一定增大,正反应速率一定大于逆反应速率
d.当达到平衡时2v正(O2)=v逆(CH4)
e.向该恒容平衡体系中充入氩气,ν正、ν逆均增大,平衡向右移动
(3)有人模拟制备原理Ⅱ,绘制如图甲图像:
i说明CO的转化率随温度升高先增大后减小的原因:______________________。
ii.反应②自发进行的条件是______________________。
iii.若在350℃时的2L的密闭容器中充入2 mol CO和6molH2,8min达到平衡,c(CH3OCH3)=0.3mol·L-1,用H2表示反应②的速率是___________;可逆反应③的平衡常数K3=___________。
iv.若350℃时测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)___________ν(逆),说明原因_________。
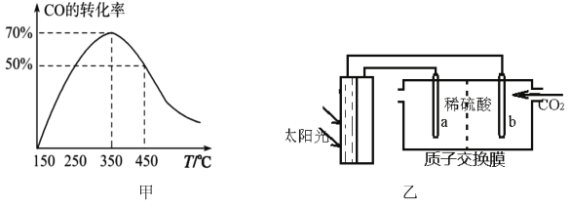
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成二甲醚的光能储存装置如图乙所示则b极的电极反应式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。查阅资料知:
①Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3。
③BaSO3难溶于水,可溶于稀HCl。
实验装置如图所示(省略夹持装置)
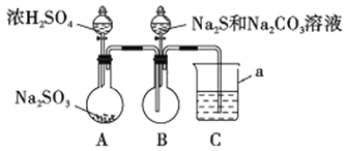
(1)仪器a的名称是_________;C中的试剂可以是______ (选填下列字母编号)。
A.稀H2SO4 B.酸性KMnO4溶液 C.饱和NaHSO3溶液 D.NaOH溶液
(2)此实验装置设计有缺陷,其改进方法是_________________________。
(3)写出B中反应的离子方程式_________________________________________。
(4)A、B中反应完后,在拆装置前,应将其中污染空气的有毒气体除去,采用的方法和具体操作是________________________________________。
(5)该法所得产品中常含有少量Na2SO3和Na2SO4。为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,加足量BaCl2溶液,有白色沉淀生成,_______________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(6)测定产品纯度:准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2=S4O62-+2I-)
①滴定至终点时,溶液颜色的变化是_______________________。
②滴定记录数据如下表:
滴定前读数/mL | 滴定后读数/mL | |
第一次 | 0.10 | 16.12 |
第二次 | 1.10 | 17.08 |
第三次 | 1.45 | 19.45 |
第四次 | 0.00 | 16.00 |
③产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:用NH3催化还原NOx时包含以下反应。
反应①:4NH3(g) + 6NO(g) ![]() 5N2(g) + 6H2O(l) H1 = -1807.0kJmol-1
5N2(g) + 6H2O(l) H1 = -1807.0kJmol-1
反应②:4NH3(g) + 6NO2(g) ![]() 5N2(g) + 3O2(g) + 6H2O(l) H2 = ?
5N2(g) + 3O2(g) + 6H2O(l) H2 = ?
反应③:2NO(g) + O2(g) ![]() 2NO2(g) H3 = -113.0kJmol-1
2NO2(g) H3 = -113.0kJmol-1
(1)反应②的H2 =_________________________。 反应①②在热力学上趋势大,其原因是___________________________________________________________________。
(2)为探究温度及不同催化剂对反应①的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得N2浓度变化情况如下图所示。

①反应①的平衡常数的表达式K=__________。在催化剂甲的作用下反应的平衡常数_______________在催化剂乙的作用下反应的平衡常数(填写“大于”,“小于”或“等于”)。
②N点后N2浓度减小的原因可能是_________________、 ________________。
(3)某温度下,在1L容器中对于反应①初始投入4molNH3和6molNO,当气体总物质的量为7.5mol时反应达到平衡,则NH3的转化率_______________% ,达平衡所用时间为5分钟,则用NO表示此反应平均反应速率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积相同的两个密闭容器中分别充满O2和N2,当这两个容器内温度和气体密度都相等时,下列说法正确的是( )
A. 两种气体的压强相等B. 氧气比氮气的质量大
C. 两种气体的分子数目相等D. 氮气中的含有的原子数多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池的负极是作为电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生 MnOOH。废旧电池中的Zn、Mn元素的回收,对环境保护有重要的意义。
Ⅰ. 回收锌元素,制备ZnCl2
步骤一:向除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得固体和滤液。
步骤二:处理滤液,得到ZnCl2·xH2O晶体。
步骤三:将SOCl2与ZnCl2·xH2O晶体混合制取无水ZnCl2。
制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略) 的装置如下:

(已知: SOCl2是一种常用的脱水剂,熔点-105℃,沸点79℃,140℃以上时易分解,与水剧烈水解生成两种气体。)
(1)写出SOCl2与水反应的化学方程式:______________________。
(2)接口的连接顺序为a→___→___→ h → h →___→___→___→e。______________
Ⅱ. 回收锰元素,制备MnO2
(3)洗涤步骤一得到的固体,判断固体洗涤干净的方法:_________________________。
(4)洗涤后的固体经初步蒸干后进行灼烧,灼烧的目的__________________________。
Ⅲ. 二氧化锰纯度的测定
称取1.40g灼烧后的产品,加入2.68g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参与反应),充分反应后冷却,将所得溶液转移到100mL容量瓶中用蒸馏水稀释至刻线,从中取出20.00mL,用0.0200mol/L高锰酸钾溶液进行滴定,滴定三次,消耗高锰酸钾溶液体积的平均值为17.30mL。
(5)写出MnO2溶解反应的离子方程__________________________________________。
(6)产品的纯度为______________________ 。
(7)若灼烧不充分,滴定时消耗高锰酸钾溶液体积_____(填“偏大”、“ 偏小”、“ 不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )

A. t℃时,Y点和Z点时Ag2CrO4的Ksp相等
B. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C. t℃时,Ag2CrO4的Ksp为1×10-8
D. t℃时,将0.01mol·L-1 AgNO3溶液滴入20mL0.01mol·L-1 KCl和0.01mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com