
【题目】Ⅰ.CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)用甲烷与水蒸气制备合成气,每生成1mol合成气,需要供给51.5 kJ热量。该反应的热化学方程式为_____________________________________________________。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),发生反应: CH4(g) + H2O(g) ![]() CO(g) + 3H2(g)。测得CH4和H2的物质的量浓度随时间变化如下表所示:
CO(g) + 3H2(g)。测得CH4和H2的物质的量浓度随时间变化如下表所示:
时间/min 物质的浓度(mol/L) | 0 | 1 | 2 | 3 | 4 |
CH4 | 0.2 | 0.13 | 0.1 | 0.1 | 0.09 |
H2 | 0 | 0.21 | 0.3 | 0.3 | 0.33 |
①该反应第一次达平衡时的平衡常数K=_______________。
②3min时改变的反应条件是__________________(只填一种条件的改变即可)。
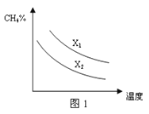
(3)已知一定压强下,温度、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。图1中的两条曲线所示投料比的关系X1 ______X2(填“=”、“>”或“<”)。
Ⅱ.(4)已知常温下HCOOH的电离常数为![]() ,则HCOO—的水解反应HCOO- + H2O
,则HCOO—的水解反应HCOO- + H2O ![]() HCOOH + OH-的平衡常数K h =__________________。
HCOOH + OH-的平衡常数K h =__________________。
(5)常温下,将a mol/L的HCOOH溶液与a/2mol/L的NaOH溶液等体积混合后,溶液中各离子浓度由大到小的顺序是______________________________。
(6)常温下,在a mol/L的HCOOH溶液中加入等体积的bmol/L的NaOH溶液至溶液呈中性,此时溶液中HCOOH的物质的量浓度为______________________。
【答案】CH4(g) + H2O(g)=CO(g) + 3H2(g) △H=+206kJ/mol0.135升高温度或增大c(H2O)>5×![]() c(HCOO-)>c(Na+)>c(H+) >c(OH-)(a-b)/2
c(HCOO-)>c(Na+)>c(H+) >c(OH-)(a-b)/2
【解析】
(1)根据热化学方程式的书写方法,先写出方程式并标注状态,再根据热量与化学计量数计算焓变,则用甲烷与水蒸气制备合成气,每生成1mol合成气,需要吸收51.5KJ热量,该反应的热化学方程式为: CH4(g) + H2O(g)=CO(g) + 3H2(g) △H=+206kJ/mol;
(2)①反应方程式为: CH4(g) + H2O(g)=CO(g) + 3H2(g),
初起量(mol/L) 0.2 0.3 0 0
变化量(mol/L) 0.1 0.1 0.1 0.3
平衡量(mol/L) 0.1 0.2 0.1 0.3
所以![]() ;
;
②3min时改变的反应条件,反应向正反应方向进行,可能为升高温度或增大H2O的浓度;
(3)碳水比X[n(CH4)/n(H2O)]值越大,平衡时甲烷的转化率越低,含量越高,故X1 >X2;
(4)醋酸的电离平衡常数为![]() ,醋酸根离子水解的平衡常数为:
,醋酸根离子水解的平衡常数为:![]() ,已知
,已知![]() ,由以上公式可知
,由以上公式可知![]() ;
;
(5)将a mol/L的HCOOH溶液与a/2mol/L的NaOH溶液等体积混合后,得到的是等浓度的甲酸钠和甲酸的混合物,溶液显示酸性,甲酸的电离程度大于甲酸根离子的水解程度,离子浓度大小顺序是:c(HCOO-)>c(Na+)>c(H+) >c(OH-);
(6)根据溶液显示中性,所以c(OH-)=C(H+),根据电荷守恒,得到c(HCOO-)=c(Na+),根据物料守恒,溶液中c(HCOOH)=(a-b)/2 mol/L。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
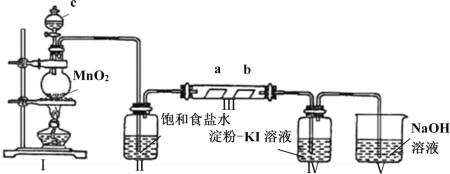
(1)装置Ⅰ中仪器c的名称是_______________,实验室以二氧化锰和浓盐酸制备氯气的离子方程式为_______________________________________________________。
(2)装置Ⅱ的作用是________________________。
(3)实验过程中装置Ⅳ中的实验现象为______________________________。
(4)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置Ⅱ与III之间添加下图中的_______装置(填序号)。

(5)装置Ⅴ的目的是防止尾气污染空气,写出装置Ⅴ中发生反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.氢氧化铝可用于中和过多胃酸
B.赏心悦目的雕花玻璃可用HF刻蚀而成
C.空气质量报告中有可吸入颗粒、SO2、NO2、CO2
D.光化学烟雾的形成与氮氧化物有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中有①NH4+、②Mg2+、③Fe2+、④Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
A.①② B.①③ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将![]() 体积NO和
体积NO和![]() 体积O2同时通入倒立于水中且盛满水的容器中,充分反应后,容器内残留
体积O2同时通入倒立于水中且盛满水的容器中,充分反应后,容器内残留![]() 体积的气体,该气体与空气接触变为红棕色,则
体积的气体,该气体与空气接触变为红棕色,则![]() 为( )
为( )
A. 3:2 B. 2:3 C. 8:3 D. 3:8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2+11O2=4B2O3 +2V2O5。下列说法不正确的是
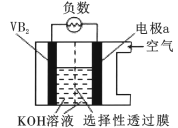
A. 电极a 为电池正极
B. 图中选择性透过膜为阴离子透过性膜
C. 电池工作过程中,电极a附近区域pH减小
D. VB2极发生的电极反应为:2VB2 +22OH--22e- = V2O5+2B2O3 + 11H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲烷为原料合成甲醇的反应如下:
反应I:CH4(g) + CO2(g) ![]() 2CO(g) + 2H2(g) △H1= +247 kJ/mol
2CO(g) + 2H2(g) △H1= +247 kJ/mol
反应II:CO(g) + 2H2(g)![]() CH3OH(g) △H2=-90kJ/mol
CH3OH(g) △H2=-90kJ/mol
已知: T1℃时,反应II 的平衡常数数值为100;T2℃时,反应II 在密闭容器中达到平衡,测得CO、H2、CH3OH的物质的量浓度(mol/L)分别为0.05、0.1、0.1。下列说法中,正确的是
A. 反应I中,使用催化剂可以减小△H1,提高反应速率
B. 反应II 中,加热或加压均可提高原料气的平衡转化率
C. 由上述数据可判断反应II 的温度: T1> T2
D. CO(g)+CH3OH(g)![]() CH4(g) +CO2(g) △H= +157 kJ/mol
CH4(g) +CO2(g) △H= +157 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C. 标准状况下,22.4 L H2O的分子数为1NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com