
在稀硫酸酸化的含6 mol KI溶液中逐滴加入KBrO3溶液,整个过程中含碘物质与所加入KBrO3物质的量的关系如图。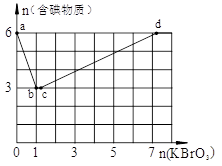
请回答下列问题:
(1)b点时,对应含碘物质的化学式为 。
(2)b→c过程中,仅有一种元素发生化合价变化,写出该反应的化学方程式并标出电子转移方向与数目 。
(3)当n(KBrO3)=4mol时,体系中对应含碘物质的化学式为 。
(4)酸性条件下,Br2、IO3-、BrO3-、I2氧化性由强到弱的顺序为 。
(5)在稀硫酸酸化的KBrO3溶液中不断滴入淀粉KI溶液,边滴边振荡。则实验过程中的可能观察到的现象为 。
(1)I2;(1分)
(2)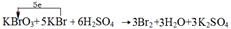 (2分)
(2分)
(3)KIO3和I2(2分)
(4)BrO3- > IO3- > Br2 > I2(1分)。
(5)溶液先无色,后变蓝色,合理给分(2分)。
解析试题分析:(1)b点时,KI反应完全,有图象可知参加反应的KI为6mol,KBrO3为1mol,则消耗的氧化剂与还原剂物质的量之比为1;6,发生反应为6I-+BrO3-=Br-+3I2,还原产物是KBr,故答案为:1:6;KBr;(2)b→c过程中,仅有一种元素发生化合价变化,应是BrO3-与Br-之间的氧化还原反应,反应的离子方程式为BrO3-+5Br-+6H+=3Br2+3H2O,故答案为:BrO3-+5Br-+6H+=3Br2+3H2O;(3)①反应2BrO3-+I2=2IO3-+Br2中,I2为还原剂,Br2为还原产物,应有还原性I2>Br2,该同学的结论不正确,故答案为:不正确,该反应中I2作还原剂,Br2为还原产物,应得出还原性I2>Br2结论(合理即可);②n(KBrO3)=4时,发生的反应依次有6I-+BrO3-=Br-+3I2,BrO3-+5Br-+6H+=3Br2+3H2O,2BrO3-+I2=2IO3-+Br2,6molKI生成I2,需要1molKBrO3,同时生成1molKBr,发生BrO3-+5Br-+6H+=3Br2+3H2O,需要0.2molKBrO3,如I2完全被氧化生成KIO3,还应需要6molKBrO3,则n(KBrO3)=4时,对应含碘物质的化学式为I2,KIO3,故答案为:I2,KIO3;(4)发生的反应依次有6I-+BrO3-=Br-+3I2,BrO3-+5Br-+6H+=3Br2+3H2O,2BrO3-+I2=2IO3-+Br2,总反应为6I-+6BrO3-=5IO3-+3Br2,则含amolKI的硫酸溶液所能消耗n(KBrO3)的最大值为1.2amol,故答案为:1.2a。
考点:本题考查氧化还原反应,题目难度中等,本题注意根据关系的关系式计算,为解答该题的关键,也是易错点。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
某溶液甲中可能含有下列离子中的几种:K+、NO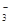 、SO
、SO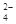 、NH
、NH 、CO
、CO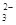 (不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
(不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为672mL;
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g。
(1)甲溶液中一定存在的离子是 ;
(2)甲溶液中一定不存在的离子是 ;
(3)甲溶液中可能存在的离子是 ;你得出此结论的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种。现进行以下实验:
①取少量白色固体加到足量的水中,得到白色沉淀,上层清液为无色。
②向上述悬浊液中加入足量的稀硝酸,白色沉淀消失,并有气泡产生。
③取少量②的溶液滴入硝酸钡溶液,有白色沉淀生成,再加入稀硝酸,白色沉淀不消失。
根据上述实验现象判断:白色固体中一定含有 ,
一定不含有 , 可能会有 ;
上述实验中有关反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
周期表中前36号元素A、B、C、D、E、F、G、H,它们的原子序数依次增大,其中B、C、D为同一周期;E、F、G为同一周期;A和E、D和G分别为同一主族;A与B组成的化合物是一种温室气体;D元素原子的最外层电子数是次外层电子数的3倍;E是所在周期原子半径最大的元素(除稀有气体外);F元素的离子半径是同周期元素形成的简单离子中最小的;H元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
(1)E2D2物质中化学键的类型是__________________
(2)一定条件下,A2气体与C2气体充分反应可生成6.8 g的气体,放出18.44 kJ热量,则该反应的热化学方程式为:______________________________________________________;生成物分子的空间构型为_________________,其中C的杂化方式为_______________。
(3)C和E组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 。
(4)H的基态原子的电子排布式为__________________________已知H2+能与(2)中的生成物的水溶液形成配合物,请写出该配合物中阳离子的结构简式:_________________,在此配合物的水溶液中加入乙醇,现象是_______________________________________。
(5)某无色溶液可能存在如下离子:Ag+、Ba2+和由上推出的元素组成的离子E+、F3+、FD2―、G2―、BD32―、GD32―、GD42―,现取该溶液进行有关实验,结果如下图所示。
①生成淡黄色沉淀的离子方程式为 。
②由溶液甲生成沉淀乙的离子方程式 。
③综合上述信息,可以肯定存在的离子有 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、A13+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过比较分析,认为无须检验就可判断五种物质中肯定有的两种物质是_____________和__________。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体。则X为__________(填字母)。
A.Br- B.SO42- C.CH3COO- D.HCO3-
(3)将19.2g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式__________,若要将Cu完全溶解,至少应加入H2SO4的物质的量是_____ __。
(4)若用惰性电极电解C和D的混合溶液,若溶质的物质的量均为0.1 mol,通电后,当在阴极产生气体1.12L时,阳极产生的气体体积为___________L。(气体体积均为标准状况,且不考虑气体在水中的溶解)
(5)将E溶液蒸干后并将所得固体灼烧,最终得到的固体成分是(填化学式)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是____________;所含阴离子相同的两种盐的化学式是 。
(2)D的化学式为_________,D溶液显碱性的原因是(用离子方程式表示):
。
(3)E和氨水反应的离子方程式是___________________________________ _____。
(4)设计实验检验B中所含的阳离子:
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铬及其化合物常被应用于冶金、化工、电镀、制药、纺织等行业,但使用后的废水因其中含高价铬的化合物而毒性很强。工业上往往采取下列循环工艺防止铬的污染: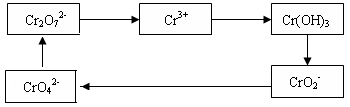
完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下:
Cr2O72- + Fe3O4 + H+ → Cr3+ + Fe3+ + H2O
配平上述离子反应方程式,并标出反应中电子转移的方向和数目。
(2)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。写出从该沉淀中分离出Cr(OH)3的离子方程式 、
。
(3)回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:
① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I-
准确称取纯净的K2Cr2O7 0.1225g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为 (保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3 g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24 L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。
另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
(1)试通过计算确定该结晶水合物的化学式为 ;
(2)假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0 mol·L-1。
①加入少量Ba(OH)2溶液,则反应的离子方程式为 ;
②加入一定量的Ba(OH)2溶液后,若所得沉淀的总物质的量最大,则反应的离子方程式为 ;
③若加入75 mL的Ba(OH)2溶液,则得到的沉淀质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断不正确的是
| A.与NaOH反应的氯气一定为0.15 mol |
| B.n(Na+)∶n(Cl-) 可能为7∶3 |
| C.若反应中转移的电子为n mol,则n一定大于0.15 mol |
| D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为7∶2∶1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com