
【题目】芯片主要由单晶体硅成。下图是硅及其化合物的类价二维图,根据要求完成下列化学方程式或离子方程式。
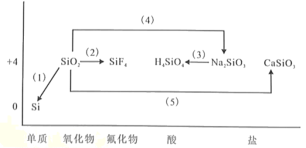
(1)利用焦炭在电炉中还原二氧化硅的化学方程式为_______________。
(2)利用氢氟酸刻蚀玻璃的化学方程式为_______________。
(3)硅酸钠转化为原硅酸的离子方程式_______________。
(4)二氧化硅与烧碱溶液反应的化学方程式_______________。
(5)石英与纯碱在玻璃熔炉里加强热发生反应的化学方程式为_______________。
【答案】SiO2+2C![]() Si+2CO↑ SiO2+4HF=SiF4↑+2H2O SiO32-+2H++H2O=H4SiO4↓ 2NaOH+SiO2=Na2SiO3+H2O Na2CO3+SiO2
Si+2CO↑ SiO2+4HF=SiF4↑+2H2O SiO32-+2H++H2O=H4SiO4↓ 2NaOH+SiO2=Na2SiO3+H2O Na2CO3+SiO2![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
【解析】
(1)碳与二氧化硅反应生成一氧化碳气体和硅;
(2)二氧化硅与HF反应生成四氟化硅和水;
(3)硅酸盐与酸反应生成原硅酸沉淀;
(4)二氧化硅是酸性氧化物,与烧碱溶液反应生成硅酸钠和水;
(5)二氧化硅与碳酸钠在高温下反应生成硅酸钠和二氧化碳。
(1)碳的还原性比硅强,C还原二氧化硅制粗硅,化学反应为SiO2+2C![]() Si+2CO↑,故答案为:SiO2+2C
Si+2CO↑,故答案为:SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
(2)二氧化硅与HF反应生成四氟化硅和水,其反应的方程式为:SiO2+4HF=SiF4↑+2H2O;故答案为:SiO2+4HF=SiF4↑+2H2O;
(3)硅酸盐与酸反应生成原硅酸或硅酸,反应的离子方程式为:SiO32-+2H++H2O=H4SiO4↓,故答案为:SiO32-+2H++H2O=H4SiO4↓;
(4)二氧化硅与烧碱溶液反应生成硅酸钠和水,反应的化学方程式为:2NaOH+SiO2=Na2SiO3+H2O,故答案为:2NaOH+SiO2=Na2SiO3+H2O;
(5)纯碱为碳酸钠,与成分为二氧化硅的石英,反应生成硅酸钠和二氧化碳,反应化学方程式为:Na2CO3+SiO2![]() Na2SiO3+CO2↑,故答案为:Na2CO3+SiO2
Na2SiO3+CO2↑,故答案为:Na2CO3+SiO2![]() Na2SiO3+CO2↑。
Na2SiO3+CO2↑。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中N元素显-3价,用原子结构解释N元素显负价的原因是_______。
②NaClO溶液可将CN-氧化成N2、HCO3-,从而消除CN-污染,反应的离子方程式为_____。
(2)含乙酸钠和对氯酚(![]() )的废水可以利用微生物电池除去,其原理如图所示。
)的废水可以利用微生物电池除去,其原理如图所示。
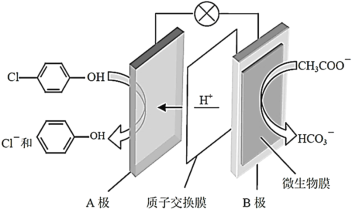
①A是电池的_________极(填“正”或“负”);
②B极的电极反应式为_______。
(3)含重金属铬(Ⅵ)的废水具有较强的毒性,离子交换树脂(ROH)法可将有毒废水中的CrO42-和Cr2O72-吸附至树脂上除去,原理如下:2ROH+CrO42-→R2CrO4+2OH-、2ROH+Cr2O72-→R2Cr2O7+2OH- (已知:废水中存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O)。
Cr2O72-+H2O)。
控制溶液酸性可以提高树脂对铬(Ⅵ)的去除率,其理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,由一氧化碳和二氧化碳组成的混合气体为6.72 L,质量为12g,此混合物中一氧化碳和二氧化碳物质的量之比是__________,一氧化碳的体积分数是__________,一氧化碳的质量分数是__________,碳原子和氧原子个数比是__________,混合气体的平均相对分子质量是__________,密度是__________g·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯是煤干馏的产物,可用于制备具有止痛退热效果的冬青油( 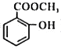 ),合成路线如下:
),合成路线如下:
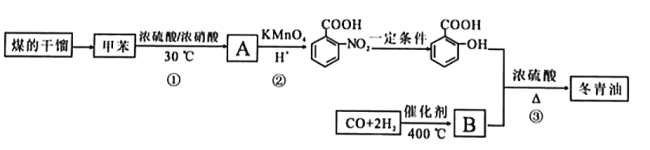
已知: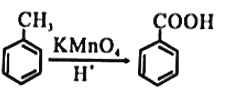
请回答下列问题
(1)煤的干馏是_______________。(填“物理变化”或“化学变化”).
(2)A的结构简式为_______________。反应①的反应类型是_______________。
(3)反应②的反应类型是_______________。
(4)B的官能团名称为_______________。
(5)反应③的化学方程式_______________。
(6)C是冬青油的同分异构体,其苯环上的取代基与冬青油相同,则C的结构简式可能为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(任务一)探究墨粉中铁的氧化物。墨粉是由树脂和炭黑、电荷剂、磁粉(铁氧化物)等组成。
(1)向一定量墨粉中加入适量的稀硫酸充分振荡后,向试管中缓缓压入棉花团至试管底部,棉花团所起的作用是___________。
(2)取(1)中水层部分清液,把清液分装两试管,一试管中加入适量![]() 溶液,出现_________,证明有Fe3+,另一试管中加入铁氰化钾溶液,立即出现______,证明有Fe2+。
溶液,出现_________,证明有Fe3+,另一试管中加入铁氰化钾溶液,立即出现______,证明有Fe2+。
(任务二)设计实验方案,测定墨粉中铁元素的质量分数。取![]() 墨粉经过一系列操作,配制成
墨粉经过一系列操作,配制成![]() 溶液(溶液中铁元素全部转化为Fe3+),取出
溶液(溶液中铁元素全部转化为Fe3+),取出![]() 溶液,用
溶液,用![]() 的
的![]() 溶液滴定。
溶液滴定。
(1)滴定过程中,选择的指示剂是______。
a.淀粉溶液 b. ![]() 溶液 c.
溶液 c.![]() 溶液 d.
溶液 d.![]() 溶液
溶液
(2)若滴定过程中消耗![]() 溶液
溶液![]() ,则墨粉中铁的质量分数为______(百分数保留两位整数)。
,则墨粉中铁的质量分数为______(百分数保留两位整数)。
(任务三)了解![]() 的工业制备。复印机使用的墨粉的主要成分是
的工业制备。复印机使用的墨粉的主要成分是![]() ,如图是利用硫铁矿烧渣制备高纯
,如图是利用硫铁矿烧渣制备高纯![]() 的工艺流程。
的工艺流程。

已知:
①![]() ;
;
②![]() 在水中可溶,在乙醇中难溶;
在水中可溶,在乙醇中难溶;
③![]() 在乙醇与水的混合溶剂中的溶解度随乙醇体积分数的变化曲线如图所示:
在乙醇与水的混合溶剂中的溶解度随乙醇体积分数的变化曲线如图所示:

回答下列问题:
(1)①浸出液中含有的金属阳离子为______________,操作②中加入铁屑的目的是_________。
(2)步骤③用![]() 作氧化剂的优点是_______。
作氧化剂的优点是_______。
(3)经步骤⑤后,一般需要对所得晶体进行洗涤和干燥处理。请说出选择乙醇和水的混合液作为洗涤液的理由___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4(s)·5H2O(s)受热分解的化学方程式为CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是( )
A. ΔH2>ΔH3 B. ΔH1<ΔH3 C. ΔH1+ΔH3=ΔH2 D. ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及其化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:

ΔH=88.6 kJ/mol则M、N相比,较稳定的是________。
(2)已知CH3OH(l)的燃烧热为-726.5 kJ·mol-1,CH3OH(l)+1/2O2(g)===CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a________726.5(填“>”“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:_______________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年2月27日至3月1日,第十届日本国际二次电池展在日本东京举行,各种新型二次电池在东京有明展览中心展出,其中以![]() 为代表的新型可充电钠离子电池,格外引人注意,其放电工作原理如图所示。下列说法正确的是( )
为代表的新型可充电钠离子电池,格外引人注意,其放电工作原理如图所示。下列说法正确的是( )

A.放电时,正极反应式为:![]()
B.放电时,电子自Mg箔流出,经含Na+的电解质流向Mo箔
C.充电时,Na+通过离子交换膜从右室移向左室
D.充电时,Mo箔接电源的负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com