
| A、在20gD216O中含有10NA个电子 |
| B、标准情况下,2.24L己烷所含分子数为0.1NA |
| C、1molCl2参加反应时转移电子数一定为2NA |
| D、含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol/L |
| m |
| M |


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
| A、1.01×105Pa,20℃时48gO3含有的分子数为NA |
| B、1molNa2O2晶体中阴离子数为2NA |
| C、标准状况下,33.6L的乙醇(C2H5OH)中含有的碳原子数目为3NA |
| D、常温常压下,7.1gCl2与足量的Fe充分反应,转移的电子数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、d、e、f |
| B、b、d、e |
| C、b、d、e、f |
| D、b、c、e、f |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
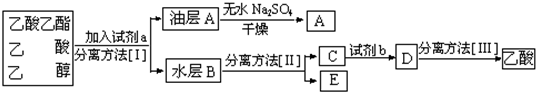
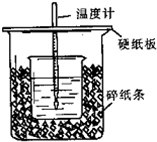
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com