
����Ŀ����ѧ������ѧϰ��ѧ����Ҫ���ߣ�����������ʾ���ʱ仯�Ļ�ѧ�����У���ȷ���ǣ�
A. Ǧ���طŵ�ʱ��������ӦʽΪPbO2��4H����SO![]() ��2e��===PbSO4��2H2O
��2e��===PbSO4��2H2O
B. ��ͭ����ʱ�����Դ�����������Ǵ�ͭ��������ӦʽΪCu2����2e��=== Cu
C. �����к�̼������ʴ�����ȴ���ǿ
D. ����Ʒ�϶�п��п������������Ʒ���������������Һ�к�Zn2��
���𰸡�B
��������
A.��Ǧ���طŵ�ʱ���ܷ�ӦPbO2+2H2SO4+Pb�T2PbSO4+2H2O��֪���ŵ�ʱ��Pb��������ӦΪ��ظ�����Ӧ���缫��ӦʽΪPb-2e-+SO42-=PbSO4����A����
B.��ͭ����ʱ����ͭΪ���������Դ����������Cu2���������ϵõ��ӱ���ԭΪCu��������ӦʽΪCu2����2e��=Cu����B��ȷ��
C.�����к���̼�����γ�ԭ���������ʴ������ʴ�������紿��ǿ����C����
D.���ʱ�����Ʋ�������������Ƽ�����������������Ʒ�϶�п��Ӧ��п������������Ʒ����������Zn2������ҺΪ�������Һ����D����
��ѡB��


 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��������Ԫ�����ڱ���һ����Ԫ�أ��ش��������⣺

��1����ϡ�����������������ԭ�Ӱ뾶��С����_____����Ԫ�ط��ţ�
��2����������ĸ�����12��Ԫ���У���ѧ��������õ���_____����Ԫ�ط��ű�ʾ����ͬ������������ǿ����___����Ԫ�ط��ű�ʾ�������ڹ���Ԫ�ص���___���ÿո��ñ��е���ĸ��ʾ��
��3��Ԫ��B�ĵ��ʺ��еĻ�ѧ��Ϊ_____�����������Ӽ������������Թ��ۼ��������Ǽ��Թ��ۼ�����
��4��D��FԪ������������Ӧˮ�������Ӧ�����ӷ���ʽΪ_____________
��5��Ϊ�Ƚ�Ԫ��A��G�ķǽ�����ǿ������ͼ��ʾװ�ý���ʵ�飨�г���������ȥ��װ�����������ã�����ҺBӦ��ѡ��_____��Һ��������_________����˵��A��G�ǽ�����ǿ���Ļ�ѧ����ʽ�ǣ�________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ˮ�����ӻ�����KWֻ���¶��йأ�������ᡢ���һ����Ӱ��ˮ�ĵ���̶�
B. Ksp���������ܵ���ʵ����ʺ��¶��йأ�������Һ��������ӵ�Ũ���й�
C. �����£���0.10 mol��L��1��NH3��H2O��Һ�м�������NH4Cl���壬��ʹ��Һ��pH��С��c(NH4+)/c(NH3��H2O)��ֵ����
D. �����£�CH3COOH��Ka��1.7��10��5��NH3��H2O��Kb��1.7��10��5��CH3COOH��Һ�е�c(H��)��NH3��H2O�е�c(OH��)���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ�Ȼ�����ij�ָ�Ч��ˮ������Ҫ�ɷ�,ʵ����������������Ҫ��Al2O3,��������Fe2O3��SiO2�����ʣ���ȡ��ʽ�Ȼ����Ĺ�������:
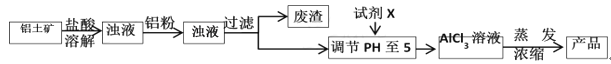
��1���ܽ���������Ҫʹ����������Ϊ15%������,���Ƹ���������IJ���������________
��2�������ܽ�������Ĺ�����,������Ӧ�����ӷ���ʽΪ____________��дһ�����ɣ�,��Ŀ����__________________________________________________________��
��3���Ӳ���������ȥ����,������Һ��pHʱ������������Ϊ__________������ţ���
A.NaOH�������� B.Al�������� C.��ˮ�������� D.Al2O3
��4��д����pH��ֽ�ⶨ�����Լ�X��������ҺpH�IJ���:�ڰ״ɰ����Ƭ�Ϸ�һСƬpH��ֽ,________________________________________________,�ó�����Һ��pH��
��5��ʵ�����������������ʯ��ȡCO2��ʵ��װ����ͼ��ʾ:
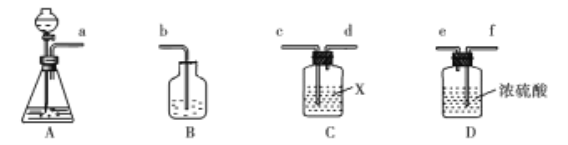
���װ���е��ܴ����ҵ�����˳��Ϊ_________,װ��C��ʢ�ŵ��Լ�XΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼú�������к��� SO2��Ϊ�����������������������ö��ַ���ʵ����������
��.(1)��ʪʽ���շ����������ռ��� SO2 ������Ӧ�Ӷ����������Լ����ʺ������÷����ռ�����_____(����ĸ���)��
a. ʯ���� b.CaCl2��Һ
(2)ij�������ú� SO2 ������������Cr2O72-�����Է�ˮ���������з�Ӧ��ĸ�Ԫ����Cr3+��ʽ���ڣ������������£�

���� SO2 ����������ˮʱ�������� SO2 ��_____�ԡ�
���������з�����Ӧ�����ӷ���ʽΪ_____��
��.ʯ��-ʯ�෨���ռ�dz��õ���������ʯ��-ʯ�෨�����շ�ӦΪCa(OH)2+SO2= CaSO3��+H2O�����ղ�����������ɹܵ���������������������ӦΪ2CaSO3+O2+4H2O =2CaSO4��2H2O����������ͼ��

�ռ�����շ�ӦΪ2NaOH+SO2=Na2SO3+H2O���÷����ص����������Ƽ���ǿ�����տ졢Ч�ʸߡ���������ͼ��

��֪��
�Լ� | Ca(OH)2 | NaOH |
�۸�(Ԫ/kg) | 0.36 | 2.9 |
���� SO2 �ijɱ�(Ԫ/mol) | 0.027 | 0.232 |
(3)ʯ��-ʯ�෨���ռ��ȣ�ʯ��-ʯ�෨���ŵ���_______��ȱ����_______��
(4)ijѧϰС����ʯ��-ʯ�෨���ռ�Ļ����ϣ����һ���Ľ��ġ���ʵ������ѭ������������������ͼ�еļס��ҡ�������_____��_____��_____(�ѧʽ)

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��������ʵ�������ȷ����
A. NaHSˮ�ⷴӦ��HS����H2O ![]() H3O����S2��
H3O����S2��
B. Fe(OH)2��ϡ���ᷴӦ��2H����Fe(OH)2=Fe2����2H2O
C. ������SO2ͨ�뵽Ư����Һ�У�ClO����SO2��H2O=HClO��HSO3-
D. Na2CO3ˮ��Һ�д���ƽ�⣺CO32��+H2O![]() HCO3��+OH��
HCO3��+OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�Ũ�Ⱦ�Ϊ0.1mol��L��1��������ҺpH���±����������е�֪ʶ����Ϣ�����жϣ�����˵����ȷ����
���� | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
pH | 11.6 | 10.3 | 9.7 | 4.0 |
A. �����£�HSO3����ˮ������ǿ�����������
B. ����ˮ�м�������NaHCO3���壬��������HClO��Ũ��
C. Na2CO3 ��Һ�д������¹�ϵ��c(Na��)��c(H��)=c(CO32��)��c(HCO3��)��c(OH��)
D. �����£���ͬ���ʵ���Ũ�ȵ�H2SO3��H2CO3��HClO��pH��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ��ѧ��Ӧԭ��������������⣺
��1��KAl(SO4)2��12H2O������ˮ������ԭ����____________________________________(�����ӷ���ʽ��ʾ)
��2��̼��������Һ���ɲ����յõ��Ĺ���������__________���ѧʽ����
��3����FeCl3��Һ�еμ�NaHCO3��Һ���г������������ɵ����ӷ���ʽ_____________��
��4����AgCl�ֱ�����5 mL H2O����10 mL 0.2 mol��L��1 MgCl2��Һ����20 mL 0.5 mol��L��1 NaCl��Һ��40 mL 0.1 mol��L-1 HCl��Һ���ܽ������ͣ�����Һ��Ag����Ũ���ɴ�С��˳����______���������գ���
��5��������a mol/L CH3COOHϡ��Һ��b mol/L KOHϡ��Һ�������ϣ���c(K+)��c (CH3COO��)����a_____________b����>��<��=����
��6�������£�1 mol/L��ͬ���������������Һ����KCl��FeCl3��HF��Na2CO3�У����������������ٵ����˳����_________________________���������գ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӳɷ�Ӧ���л���ѧ�е�һ����Ҫ�ķ�Ӧ���������ڼӳɷ�Ӧ���ǣ� ��
A.CH3Cl+Cl2![]() CH2Cl2+HCl
CH2Cl2+HCl
B.CH4��2O2![]() CO2��2H2O
CO2��2H2O
C.CH2=CH2+H2O![]() CH3��CH2OH
CH3��CH2OH
D.![]() +Br2
+Br2![]() HBr+
HBr+![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com