
【题目】利用所学化学反应原理,解决以下问题:
(1)KAl(SO4)2·12H2O可做净水剂,其原理是____________________________________(用离子方程式表示)
(2)碳酸氢钠溶液蒸干并灼烧得到的固体物质是__________(填化学式)。
(3)向FeCl3溶液中滴加NaHCO3溶液,有沉淀和气体生成的离子方程式_____________。
(4)将AgCl分别放入①5 mL H2O ②10 mL 0.2 mol·L-1 MgCl2溶液 ③20 mL 0.5 mol·L-1 NaCl溶液④40 mL 0.1 mol·L-1 HCl溶液中溶解至饱和,各溶液中Ag+的浓度由大到小的顺序是______(用序号填空)。
(5)常温下a mol/L CH3COOH稀溶液和b mol/L KOH稀溶液等体积混合:若c(K+)<c (CH3COO-),则a_____________b(填>、<、=)。
(6)室温下,1 mol/L相同体积的下列四种溶液:①KCl②FeCl3③HF④Na2CO3中,所含阳离子数由少到多的顺序是_________________________(用序号填空)。
【答案】Al3++3H2O![]() Al(OH)3(胶体)+3H+ Na2CO3 Fe 3++3HCO3-= Fe (OH)3↓+3CO2↑ ①>④>②>③ > ③<①<②<④
Al(OH)3(胶体)+3H+ Na2CO3 Fe 3++3HCO3-= Fe (OH)3↓+3CO2↑ ①>④>②>③ > ③<①<②<④
【解析】
(1)铝离子水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附性,能吸附水中悬浮物而净水;
(2)NaHCO3在加热条件下分解生成Na2CO3;
(3)NaHCO3溶液和FeCl3溶液混合发生双水解生成氢氧化铁沉淀和二氧化碳气体;
(4)AgCl在溶液中存在溶解平衡AgCl(s)![]() Cl-(aq)+Ag+(aq),所以氯离子浓度越大,Ag+的浓度就越小;
Cl-(aq)+Ag+(aq),所以氯离子浓度越大,Ag+的浓度就越小;
(5)若c(K+)<c(CH3COO-),由电荷守恒c(K+)+c(H+)=c(OH-)+c(CH3COO-)可知,所以c(OH-)<c(H+),所以a>b;
(6)假设溶液体积为1L,分别计算溶液中溶质的物质的量,然后依据强电解质完全电离,弱电解质部分电离,弱碱阳离子、弱酸根离子部分水解的性质判断解答。
(1)明矾中含有铝离子,铝离子水解生成氢氧化铝而使溶液呈酸性,水解离子方程式为:Al3++3H2O![]() Al(OH)3(胶体)+3H+,氢氧化铝胶体具有吸附性,能吸附水中悬浮物而净水,故答案为:Al3++3H2O
Al(OH)3(胶体)+3H+,氢氧化铝胶体具有吸附性,能吸附水中悬浮物而净水,故答案为:Al3++3H2O![]() Al(OH)3(胶体)+3H+。
Al(OH)3(胶体)+3H+。
(2)NaHCO3在加热条件下分解生成Na2CO3,所以得到的固体物质Na2CO3;故答案为:Na2CO3。
(3)NaHCO3溶液和FeCl3溶液混合发生双水解生成氢氧化铁沉淀和二氧化碳气体;反应的离子方程式为Fe3++3HCO3-═Fe(OH)3↓+3CO2↑,故答案为:Fe3++3HCO3-═Fe(OH)3↓+3CO2↑。
(4)AgCl在溶液中存在溶解平衡AgCl(s)![]() Cl-(aq)+Ag+(aq),所以氯离子浓度越大,Ag+的浓度就越小。②③④中氯离子的浓度分别是0.4mol/L、0.5mol/L、0.1mol/L,所以c(Ag+)由大到小的顺序是①>④>②>③;故答案为:①>④>②>③。
Cl-(aq)+Ag+(aq),所以氯离子浓度越大,Ag+的浓度就越小。②③④中氯离子的浓度分别是0.4mol/L、0.5mol/L、0.1mol/L,所以c(Ag+)由大到小的顺序是①>④>②>③;故答案为:①>④>②>③。
(5)若c(K+)<c(CH3COO-),由电荷守恒c(K+)+c(H+)=c(OH-)+c(CH3COO-)可知,所以c(OH-)<c(H+),所以a>b,故答案为:>。
(6)假设溶液体积为1L,浓度均为1molL-1相同体积的下列四种溶液,①含有KCl物质的量为1mol,氯化钾为强电解质,完全电离所以含有钾离子物质的量为1mol;②含有FeCl3物质的量为1mol,氯化铁为强电解质完全电离产生1mol三价铁离子,铁离子为弱碱阳离子,部分水解,所以溶液中三价铁离子水解:Fe3++3H2O![]() Fe(OH)3+3H+,所以阳离子物质的量略大于1mol;③含有HF物质的量为1mol,HF为弱电解质,部分电离,所以含有的氢离子小于1mol;④含有碳酸钠的物质的量为1mol,碳酸钠为强电解质完全电离,产生2mol钠离子,所以含有阳离子物质的量为2mol;
Fe(OH)3+3H+,所以阳离子物质的量略大于1mol;③含有HF物质的量为1mol,HF为弱电解质,部分电离,所以含有的氢离子小于1mol;④含有碳酸钠的物质的量为1mol,碳酸钠为强电解质完全电离,产生2mol钠离子,所以含有阳离子物质的量为2mol;
所以上述溶液中含有阳离子数目由少到多的顺序为:③<①<②<④,故答案为:③<①<②<④。


科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z
2Z
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 升高温度平衡常数增大,则此反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是:
A. 铅蓄电池放电时,负极反应式为PbO2+4H++SO![]() +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
B. 粗铜精炼时,与电源负极相连的是纯铜,阴极反应式为Cu2++2e-=== Cu
C. 生铁中含碳,抗腐蚀能力比纯铁强
D. 铁制品上镀锌,锌做阴极,铁制品做阳极,电解质溶液中含Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:

注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入2mL甲苯和一定量其它试剂,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。

(1)装置a的名称是_____,主要作用是________。三颈瓶中发生反应的化学方程式为_______。
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是_________。
(3)反应完毕,反应混合液经过自然冷却至室温后,还应经过__________、________(填操作名称)等操作,才能得到苯甲醛粗产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的实验步骤是______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.与适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸(相对分子质量为122)产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000 mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为_______(保留一位小数)。下列情况会使测定结果偏低的是____(填字母)。
a.滴定终了俯视读取数据 b.KOH标准液长时间接触空气
c.配制KOH标准液时仰视定容 d.将指示剂换为甲基橙溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某优质甜樱桃中含有一种羟基酸(用M表示),M的碳链结构无支链,分子式为C4H6O5;1.34 g M与足量的碳酸氢钠溶液反应,生成标准状况下的气体0.448 L。M在一定条件下可发生如下转化:M![]() A
A![]() B
B![]() C(M、A、B、C分子中碳原子数目相同)。下列有关说法中不正确的是( )
C(M、A、B、C分子中碳原子数目相同)。下列有关说法中不正确的是( )
A. M的结构简式为HOOC—CHOH—CH2—COOH
B. B的分子式为C4H4O4Br2
C. 与M的官能团种类、数量完全相同的同分异构体还有2种
D. C物质不可能溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25 ℃、101 kPa)的气体摩尔体积。该小组设计的简易实验装置如图所示:
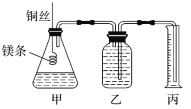
该实验的主要操作步骤如下:
①用已知浓度的浓盐酸配制100mL 1.0mol·L-1的盐酸(需要用到的仪器有量筒、烧杯、__________;
②用10mL的量筒量取8.0mL 1.0mol·L-1的盐酸加入锥形瓶中;
③准确称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为_____;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请回答下列问题:
(1)步骤①中,配制100mL 1.0mol·L-1的盐酸时,下列会使所配制溶液的浓度偏小的操作有____(填字母)。
A 用量筒量取浓盐酸时,俯视量筒的刻度线
B 容量瓶未干燥即用来配制溶液
C 浓盐酸在烧杯中稀释时,搅拌时间过长
D 定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线未做处理
E 在容量瓶中定容时俯视容量瓶刻度线
F 烧杯中有少量水
G 未冷却至室温即定容
(2)实验步骤⑤中应选用的量筒规格是_______
(3)读数时需要注意(至少写两点):______。
(4)忽略水蒸气影响,在该条件下测得气体摩尔体积的计算式为Vm=___L·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究 SO2 气体还原 Fe3+,他们使用的药品和装置如图所示,下列说法不合理的是( )

A.为了验证 A 中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
B.为了验证 A 中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
C.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
D.装置C的作用是吸收SO2尾气,防止污染空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际计量大会新修订了阿伏加德罗常数(NA=6.02214076×1023mol1),并于2019年5月20日正式生效。下列有关NA说法正确的是
A.22.4LCH2=CHCH3分子中含碳碳双键的数目为NA
B.1mol羟基(﹣OH)所含的电子总数为9NA
C.常温常压下,14g聚乙烯含有原子总数为3NA
D.64 g S2和S8混合物中含硫原子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中必定伴随着能量变化,通常表现为热量的变化——放热或者吸热。其中有些放热的化学反应通过原电池装置可以转化为电能。
Ⅰ.已知H2(g)+![]() O2(g)=H2O(g),如图是1molH2燃烧的反应过程中能量变化示意图。请回答下列问题:
O2(g)=H2O(g),如图是1molH2燃烧的反应过程中能量变化示意图。请回答下列问题:

(1)该反应是______(填“吸热”或“放热”)反应。
(2)氢气在氧气中燃烧,破坏1molH—H键吸收Q1kJ的能量,破坏1molO=O键吸收Q2kJ的能量,形成1molH—O键释放Q3kJ的能量,则下列关系式正确的是_______。
A.2Q1+Q2>4Q3 B.2Q1+Q2<4Q3
C.Q1+Q2<Q3 D.2Q1+Q2=4Q3
Ⅱ.如图为原电池装置示意图:

(3)若A为铜片,B为铁片,电解质为FeCl3溶液,则铁片为____极(填“正”或“负”),写出正极反应式__________。
(4)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为燃料电池,通入氧气的一极为该电池的____极(填“正”或“负”),写出该电池的负极反应式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com