
【题目】下图是某工业生产过程。

溶解度表:
温度℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
氯化铵 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 55.2 | 65.6 | 71.3 | 77.3 |
硫酸铵 | 70.6 | 73 | 75.4 | 78 | 81 | 88 | 95 | 98 | 103 |
硫酸钾 | 7.4 | 9.3 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 22.9 | 24.1 |
氯化钾 | 28 | 31.2 | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 53.9 | 56.3 |
(1)本工业生产过程的目标产品是____________________________________。(写化学式)
(2)过滤Ⅰ操作所得固体中,除CaCO3外还有一种物质,该固体的用途有_________(试举一例)。
(3)根据溶解度表转化Ⅱ适宜的温度是________
A、0~10℃ B、20~30℃ C、40~60℃ D、90~100℃
过滤Ⅱ操作所得滤渣是__________。
(4)我国著名的化学家也利用了转化Ⅱ的反应原理制备了一种重要的碱,该制备的化学反应方程式为:___________________________________________________
(5)氯化钙结晶水合物(CaCl2·6H2O)进行脱水处理可制得常用的干燥剂,根据下图选择最佳脱水的方法是__________

A、氯化氢气流中加热到174℃ B、直接加热至174℃
C、直接加热至260℃ D、氯化氢气流中加热到260℃
(6)上述工业流程实现了绿色化学的理念,其中__________________(填化学式)实现了循环利用,副产品_________________________(填化学式)可转化为原料,整个流程基本实现了污染物零排放。
【答案】 CaCl2·6H2O 做石膏模型;加入到水泥中调节水泥的硬化速率;做建筑材料 D K2SO4(或K2SO4 和KCl) NH3+H2O+NaCl+CO2=NH4Cl+NaHCO3↓ C NH3 CaCO3
【解析】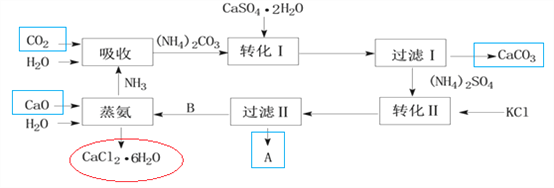
(1)根据上面流程,起点由水吸收氨气,再吸收二氧化碳,最后转化产出的为红色圈的CaCl2·6H2O,本工业生产过程的目标产品是CaCl2·6H2O;而箭头指出的CaCO3受热分解可提供氧化钙和二氧化碳,根据溶解性表中硫酸铵、氯化钾、硫酸钾和氯化铵中硫酸钾溶解度最小,在转化Ⅱ中溶解度最小的先析出,故过滤Ⅱ滤渣A为硫酸钾,即箭头指出的在流程序中间的碳酸钙和硫酸钾都不是目标产品;(2)过滤Ⅰ操作所得固体中,除CaCO3外还有一种物质,根据前面转化Ⅰ加入的石膏应该过量且是微溶,故还有的固体为石膏,用途有:做石膏模型;加入到水泥中调节水泥的硬化速率;做建筑材料等;(3)根据溶解度表转化Ⅱ适宜的温度是90~100℃,该温度范围内,硫酸铵、氯化钾、氯化铵的溶解度都比硫酸钾溶解度大得多,容易析出硫酸钾晶体;过滤Ⅱ操作所得滤渣是K2SO4(或K2SO4 和KCl);(4)我国著名的化学家也利用了转化Ⅱ的反应原理制备了一种重要的碱,该制备是在饱和食盐水中通入足量的氨气,再通入足量的二氧化碳产生碳酸氢钠,化学反应方程式为:NH3+H2O+NaCl+CO2=NH4Cl+NaHCO3↓;(5)由于CaCl2·6H2O的相对分子质量为219、假如有CaCl2·4H2O、CaCl2·2H2O、CaCl2·H2O、,则相对分子质量分别为183、147、129,CaCl2的相对分子质量为111,根据相对分子质量及质量关系,将CaCl2·6H2O转化为CaCl2最佳脱水的方法是应该选D;(6)上述工业流程(参照前面的图)实现了绿色化学的理念,其中蒸氨过程中NH3实现了循环利用,副产品CaCO3可转化为原料氧化钙和二氧化碳,整个流程基本实现了污染物零排放。


科目:高中化学 来源: 题型:
【题目】如图,在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( ) 
A.①加入的是CCl4 , ②加入苯,③加酒精
B.①加入的是酒精,②加入CCl4 , ③加苯
C.①加入的是苯,②加入CCl4 , ③加酒精
D.①加入的是苯,②加酒精,③加CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种新型清洁能源。回答问题:
(1)101KPa、25℃时,燃烧32g液态甲醇生成液态水和二氧化碳放热726.5kJ,则甲醇燃烧的热化学方程式为_____________
已知:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H=-24.5kJ·mol-1
CO(g)+2H2(g)![]() CH3OH(g) △H=akJ·mol-1
CH3OH(g) △H=akJ·mol-1
则2CO(g)+4H2(g)= CH3OCH3(g)+H2O(g) △H=__________
(2)工业上可用CO和H2制取甲醇,其热化学反应方程式为:CO(g)+2H2(g)![]() CH3OH(g) △H=akJ·mol-1,CO在不同温度下的平衡转化率与压强的关系如下图所示
CH3OH(g) △H=akJ·mol-1,CO在不同温度下的平衡转化率与压强的关系如下图所示
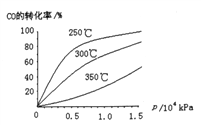
①△H______0(填“﹥”或“<”).判断依据是___________________
②为提高CO转化率,可采取的措施是_____________________________(至少答出两条)
③实际生产中,反应的条件控制在250℃,1.3×104kPa左右,选择此压强的理由是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂可用浓氨水来检验Cl2 是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)═6NH4Cl(固)+N2(气)
①用双线桥法标出电子转移的方向和数目
②若反应中消耗Cl21.5mol则被氧化的NH3在标准状况下的体积为 L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 反应NH3(g)+HCl(g)![]() NH4Cl(s)能自发进行,则该反应△H>0
NH4Cl(s)能自发进行,则该反应△H>0
B. 氨水溶液加水稀释后,溶液中 的值减小
的值减小
C. 1L1 molL-1的NaClO溶液中含有ClO-的数目为6.02×1023
D. 一定条件下,反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0达到平衡后,升高体系温度,反应重新达到平衡前,有2v正(O2)>v逆(SO3)
2SO3(g)△H<0达到平衡后,升高体系温度,反应重新达到平衡前,有2v正(O2)>v逆(SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2A(s)![]() B(g)+C(g)在体积固定的密闭容器中,起始时加入一定量的A,判断反应达到平衡状态的标志是: ①单位时间内生成2molA的同时生成1molB ②v(B):v(C)=1:1 ③密闭容器中混合气体的平均摩尔质量不变 ④混合气体的密度不再改变 ⑤B的体积分数不再改变 ⑥混合气体的压强不再改变的状态
B(g)+C(g)在体积固定的密闭容器中,起始时加入一定量的A,判断反应达到平衡状态的标志是: ①单位时间内生成2molA的同时生成1molB ②v(B):v(C)=1:1 ③密闭容器中混合气体的平均摩尔质量不变 ④混合气体的密度不再改变 ⑤B的体积分数不再改变 ⑥混合气体的压强不再改变的状态
A. ①③④⑤⑥ B. ①③④⑥ C. ①④⑥ D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com