
【题目】计算题:现有0.270g质量分数为10%的CuCl2溶液,计算:
(1)溶液中CuCl2的物质的量;
(2)溶液中Cu2+和Cl﹣的物质的量.
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法不正确的是( )
A.分子筛是一种硅酸盐产品,在工业上常用作吸附剂和催化剂
B.生活中常见的汽油、塑料、涂料、木炭、豆油等都属于有机物
C.用维生素C可以除去高锰酸钾污迹,利用了维生素C的还原性
D.苯是一种重要的化工原料,可通过煤的干馏得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某工业生产过程。

溶解度表:
温度℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
氯化铵 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 55.2 | 65.6 | 71.3 | 77.3 |
硫酸铵 | 70.6 | 73 | 75.4 | 78 | 81 | 88 | 95 | 98 | 103 |
硫酸钾 | 7.4 | 9.3 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 22.9 | 24.1 |
氯化钾 | 28 | 31.2 | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 53.9 | 56.3 |
(1)本工业生产过程的目标产品是____________________________________。(写化学式)
(2)过滤Ⅰ操作所得固体中,除CaCO3外还有一种物质,该固体的用途有_________(试举一例)。
(3)根据溶解度表转化Ⅱ适宜的温度是________
A、0~10℃ B、20~30℃ C、40~60℃ D、90~100℃
过滤Ⅱ操作所得滤渣是__________。
(4)我国著名的化学家也利用了转化Ⅱ的反应原理制备了一种重要的碱,该制备的化学反应方程式为:___________________________________________________
(5)氯化钙结晶水合物(CaCl2·6H2O)进行脱水处理可制得常用的干燥剂,根据下图选择最佳脱水的方法是__________

A、氯化氢气流中加热到174℃ B、直接加热至174℃
C、直接加热至260℃ D、氯化氢气流中加热到260℃
(6)上述工业流程实现了绿色化学的理念,其中__________________(填化学式)实现了循环利用,副产品_________________________(填化学式)可转化为原料,整个流程基本实现了污染物零排放。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,需加入氧化剂才能实现的是( )
A. Al(OH)3→Al2O3 B. FeCl3 →FeCl2 C. CuO→Cu D. Cl-→Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 对于平衡体系:2NO2(g)![]() N2O4(g),缩小容器体积后颜色先加深后变浅,但仍比原来的颜色深
N2O4(g),缩小容器体积后颜色先加深后变浅,但仍比原来的颜色深
B. 某研究性学习小组为研究酸雨的成分,收集一部分酸雨测其pH,结果一天后再测,发现雨水的pH 减小
C. 光照新制氯水时,溶液的pH 逐渐减小
D. 合成氨工厂通常采用20MPa~50MPa 的高压,以提高原料的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
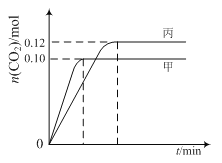
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)>v(逆)
D. T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体,而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊.D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体.请回答下列问题:
(1)写出A、B、E的化学式:A;B;E
(2)写出F和H反应的化学方程式 .
(3)按要求写方程式: ①加热固体D发生反应的化学反应方程式 .
②C与足量盐酸反应的离子方程式 .
③A溶液与金属铝反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知葡萄糖中含碳为40%,氢原子数是碳原子数的2倍,则葡萄糖的最简式为________,葡萄糖的相对分子质量是乙酸的三倍,则其分子式________。通过实验证明葡萄糖是五羟基己醛,现分别取1mol葡萄糖依次进行下列实验,根据下列各问的要求填空。
(1)跟银氨溶液微热,需银氨络离子______mol,完全反应时析出银_____g。反应后葡萄糖变为________________,其结构简式为_________________。
(2)跟乙酸进行酯化反应,按乙酸计算完全酯化时,理论上需乙酸_____mol。生成物叫做______________,其结构简式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某氧化剂中,起氧化作用的的是X2O72-,在溶液中,2个该离子恰好能使6个 SO32-产完全氧化成SO42-,则X2O72-离子中X被还原后的化合价为
A. +4 B. +3 C. +2 D. -3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com