
【题目】一定温度下,在2 L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示。请回答下列问题:
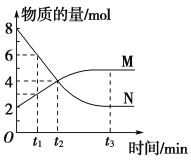
(1)该反应的化学方程式为___________。
(2)在t2时刻存在的等量关系是_____________,此时反应是否达到化学平衡状态?________(填“是”或“否”)。
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】氧化还原反应实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-=NO↑+2H2O,KMnO4、Na2CO3、Cu2O、FeSO4四种物质中有物质(甲)能使上述还原过程发生。则下列说法中正确的是
A. 在上述反应中,电子从氧化剂转移到还原剂
B. 物质甲可能是KMnO4
C. 反应中若产生3.0g气体,则转移电子数约为0.3×6.02×1023
D. 氧化过程的反应式一定为Cu2O-2e-+2H+=2Cu2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增大,
的原子序数依次增大,![]() 的最高正价与最低负价代数和为0,
的最高正价与最低负价代数和为0,![]() 、
、![]() 、
、![]() 形成的化合物甲的结构如图所示,
形成的化合物甲的结构如图所示,![]() 在同周期中原子半径最小。下列说法正确的是( )
在同周期中原子半径最小。下列说法正确的是( )
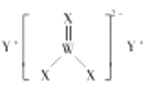
A.原子半径大小:![]()
B.电负性大小:![]()
C.![]() 、
、![]() 形成的化合物为离子化合物
形成的化合物为离子化合物
D.化合物甲中阴离子的空间构型为三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
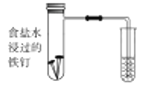
【题目】铜铁是目前人们使用量最大的合金材料,铁及其化合物也是人们日常生活中应用广泛的一类物质。回答下列问题:
(1)下图中铁钉发生的电化学腐蚀类型是________,负极反应式为__________。
(2)实验室配置![]() 溶液时,需向溶液中滴加几滴稀硫酸,其目的是__________,
溶液时,需向溶液中滴加几滴稀硫酸,其目的是__________,![]() 溶液中离子浓度由大到小的顺序是________。
溶液中离子浓度由大到小的顺序是________。
(3)高铁盐酸是一种新型的环境消毒剂及水体净化剂,如高铁酸钾(![]() )。其中
)。其中![]() 的化合价是________,其净水过程中既表现出强氧化性,又表现了强吸附性,则
的化合价是________,其净水过程中既表现出强氧化性,又表现了强吸附性,则![]() 与水反应的离子方程式为__________。
与水反应的离子方程式为__________。
(4)羰基铁酸[![]() ]是一种二元弱酸,其第一步电离方程式为__________。
]是一种二元弱酸,其第一步电离方程式为__________。
(5)25℃时,向含![]() 的溶液中加入一定量的
的溶液中加入一定量的![]() 后,
后,![]() 恰好达到溶液平衡,测得溶液的
恰好达到溶液平衡,测得溶液的![]() ,
,![]() 。通过计算判断所得的
。通过计算判断所得的![]() 中是否含有
中是否含有![]() 杂质:________(已知:
杂质:________(已知:![]() ,
,![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】西他沙星是一种广谱喹诺酮类抗菌药,可用于治疗严重的感染性疾病。一种合成西他沙星中间体![]() 的合成路线如下图所示:
的合成路线如下图所示:
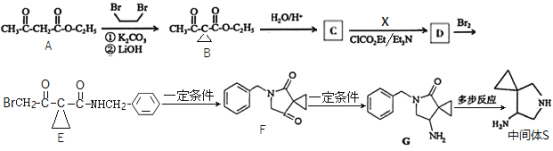
回答下列问题:
(1)![]() 的化学名称是__________。
的化学名称是__________。
(2)![]() 的结构简式为__________,
的结构简式为__________,![]() 生成
生成![]() 的反应类型是__________。
的反应类型是__________。
(3)![]() 生成
生成![]() 的化学方程式为_________________________________。
的化学方程式为_________________________________。
(4)X的同分异构体中,与X含有相同的官能团,且含苯环的有__________种(不考虑立体异构,![]() 除外);其中,核磁共振氢谱峰面积比为3:2:2:2的物质结构简式为__________(写化学式)。
除外);其中,核磁共振氢谱峰面积比为3:2:2:2的物质结构简式为__________(写化学式)。
(5)写出![]() 为原料制备
为原料制备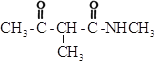 的合成路线:__________(其他试剂任选)。
的合成路线:__________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案与现象正确且能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案与现象 |
A | 证明新制氯水具有酸性 | 向新制氯水中滴加紫色石蕊试液,溶液变为红色且颜色保持不变 |
B | 证明酸性条件下,氧化性:H2O2 > Fe3 + | 向Fe(NO3)2溶液中滴加用硫酸酸化的H2O2溶液,溶液变黄色 |
C | 证明同温下,溶度积常数: Ksp(AgCl)> Ksp(Ag2CrO4) | 向体积为100 mL、浓度均为0.01 mol·L-1的NaCl和Na2CrO4混合溶液中滴加 0.01 mol·L-1AgNO3溶液,先产生白色沉淀,后产生砖红色沉淀Ag2CrO4 |
D | 证明溶液X中含有 | 向溶液X中先滴加盐酸无明显现象,再滴加BaCl2溶液,出现白色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在指定条件和相应的计量下,甲物质能与乙物质恰好都能完全反应的是
选项 | 甲 | 乙 | 条件 |
A | 1L0.4 mol·L-1氨水 | 含0.12molAlCl3的AlCl3溶液 | 常温常压 |
B | 0.9g Al | 50 mL18.4 mol·L-1H2SO4溶液 | 常温 |
C | 2.24L SO2 | 含0.1molNaOH的NaOH溶液 | 标准状况 |
D | 1mL Cl2 | 5mL H2O | 常温、避光 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学课外兴趣小组通过实验探究Fe2+、Fe3+的性质。回答下列问题:
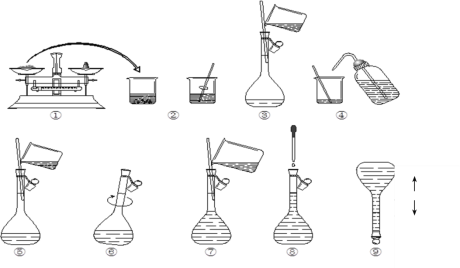
(1)本次实验中共需要1mol/LFeCl2溶液100 mL,配制时涉及到如下操作:
①步骤③中玻璃棒的作用是__;
②在配制溶液过程中步骤⑦所进行的操作是___(填“洗涤”、“转移”、“定容”);该步中视线应与溶液凹液面的最低处保持___。
③下列操作会使所配溶液物质的量浓度偏低的是___。
A.溶解后小烧杯、玻璃棒没有洗涤
B.所用容量瓶中,已有少量蒸馏水
C.定容、加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度线
(2)取2mLFeCl2溶液于试管中,加入几滴氯水,再加入1滴KSCN溶液,观察到的现象为__,说明Cl2可将Fe2+氧化成Fe3+。FeCl2溶液与氯水反应的离子方程式为___,此时将所取FeCl2溶液完全反应需__molCl2。
(3)在(2)溶液中加入过量的铁粉,溶液变成___色;发生反应的离子方程式为__,此时溶液中所含铁元素的微粒的物质的量为__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘海醇是一种临床中应用广泛的非离子型造影剂,具有耐受性好,毒性低等优点,利用碘海醇做造影剂进行肺部CT检查,能为新冠肺炎确诊及治疗提供重要参考,碘海醇的一种合成路线如下:
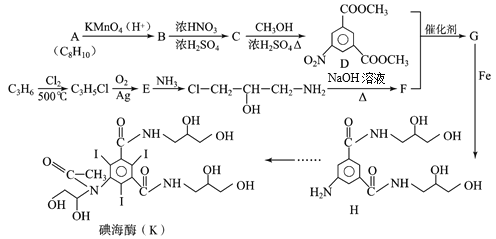
已知:①![]()
②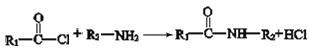
(1)已知A是苯的同系物,则A的结构简式为________。
(2)C中所含官能团的名称为_________。
(3)写出C→D的化学反应方程式_________。
(4)E的结构简式为_______。
(5)M与B互为同分异构体,M是含有苯环的酯类物质,能发生银镜反应,且苯环上一氯取代物有两种。写出任意一种符合上述条件的M的结构简式________。
(6)上述合成路线中,由合成碘海醇过程如下,下列说法正确的是________。
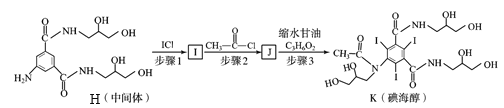
a. 步骤1中1 mol H需消耗3 mol ICl,并且有副产物HCl生成
b. 步骤2和步骤3中的反应类型相同
c. 碘海醇极易溶于水与其结构中存在较多的羟基有关
(7)有机物Q(C3H8O3)可由油脂水解制得,已知合成路线中的物质B可与Q形成交联聚合物P,P的结构片段如下:
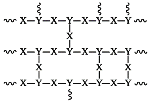
①其中![]() 的结构简式为_______。
的结构简式为_______。
②写出一定条件下相同物质的量的B与Q反应,形成线型高分子的化学方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com