
【题目】在一容积为2 L的密闭容器内为加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化的情况如图所示:
2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化的情况如图所示:
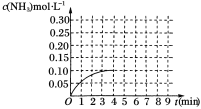
(1)根据上图,计算从反应开始到平衡时,平均反应速率υ(NH3)=___________ mol·L-1·min-1。
(2)反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为____________(填字母序号)。
A.0.20 mol·L-1 B.0.12 mol·L-1
C.0.10 mol·L-1 D.0.08 mol·L-1
(3)该反应平衡常数K=____________。
(4)反应达到平衡后,第5分钟末,保持其他条件不变,若只把容器的体积缩小一半,平衡________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数____________(填“增大”、“减小”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(设此时NH3的浓度为0.25 mol·L-1)。请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
【答案】(1)0.025(2)AC(3)59.26(4)向正反应方向、不变
(5)
【解析】
试题解析:(1)由图可知,4min达平衡,△c(NH3)=0.1mol/L,v(NH3)=![]() =0.025mol/(Lmin);
=0.025mol/(Lmin);
(2)△H<0,该反应为放热反应,升高温度逆向移动,其浓度减小,降低温度,正向移动,浓度增大,但反应物不能完全反应,所以0<c(NH3)<0.2mol/L,即NH3的物质的量浓度不可能为0.2mol/L,但是,改变温度平衡一定移动,NH3的物质的量浓度也不可能为0.1mol/L,答案选AC;
(3) N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始浓度(mol/L)0.1 0.3 0
转化浓度(mol/L)0.05 0.15 0.1
平衡浓度(mol/L)0.05 0.15 0.1
平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值,则K=![]() =
=![]() =59.26;由N2(g)+3H2(g)
=59.26;由N2(g)+3H2(g)![]() 2NH3(g)可知,生成氨气0.2mol时参加反应的氢气为0.3mol,所以氢气的转化率为
2NH3(g)可知,生成氨气0.2mol时参加反应的氢气为0.3mol,所以氢气的转化率为![]() ×100%=50%;
×100%=50%;
(4)反应达到平衡后,第5分钟末,保持其他条件不变,若只把容器的体积缩小一半,压强增大,平衡向正反应方向移动,化学平衡常数只与温度有关系,温度不变,平衡常数不变;
(5)第5分钟末将容器的体积缩小一半后,压强增大,平衡正向移动,氨气的浓度增大,在第8分钟末达到新的平衡时NH3的浓度约为0.25molL-1,则图像为:
 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某溶液遇石蕊试液显红色,下列各组离子中能在该溶液中大量共存的是
A.H+、NO3-、Ca2+、Cl-
B.Cu2+、SO42-、HCO3-、Na+
C.Fe2+、NO3-、OH-、Ba2+
D.MnO4-、SO42-、NO3-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届福建省四地六校高三上学期12月月考】
由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法正确的是( )
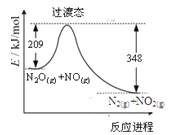
A.断键吸收能量之和大于成键释放能量之和
B.反应物总能量小于生成物总能量
C.N2O(g) +NO(g) =N2(g) +NO2(g)△H= -139kJ/mol
D.反应生成1 mol N2时转移4 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于三氧化硫的下列说法中,不正确的是 ( )
A. 常温下是一种易溶于水的气体
B. 能与碱反应生成硫酸盐和水
C. 能与氯化钡溶液反应产生沉淀
D. 能使石蕊试液变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质递变中,不能用元素周期律解释的是( )
A.溶解度:MgCO3>Mg(OH)2
B.金属性:Mg<K
C.还原性:H2S<SiH4
D.稳定性:HF>PH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C.向氯水中加CaCO3后,溶液漂白性增强
D.在含有[Fe(SCN)]2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017上海模拟】升高温度,下列数据不一定增大的是( )
A.化学反应速率v B.弱电解质的电离度α
C.化学平衡常数K D.水的离子积常数Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO4和NaHCO3是常见的酸式盐,是水溶液中离子平衡部分重要的研究对象。请运用相关原理,回答下列有关小题。
(1)NaHSO4在水中的电离方程式为 。室温下,pH=5的NaHSO4溶液中水的电离程度 (填“>”、”=”或“<”)pH=9的氨水中水的电离程度。
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因为 (用离子方程式表示)。
(3)室温下,若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+)+c(NH) c(SO![]() )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。
(4)室温下,用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO![]() 完全沉淀,则反应后溶液的pH__________7(填“>”、”=”或“<”)。
完全沉淀,则反应后溶液的pH__________7(填“>”、”=”或“<”)。
(5)室温下,0.1 mol/L 的NaHCO3溶液的pH为8.4,同浓度的NaAlO2溶液的pH为12.4,同浓度的Na2CO3溶液的pH是11.4。
①将NaHCO3溶液和NaAlO2溶液等体积混合,可能发生的现象是 ,其主要原因是 (用离子方程式表示)。
②上述溶液中,由NaHCO3水解产生的c(OH-)是由 Na2CO3水解产生c(OH-)的 倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com