
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。请回答下列问题:
(1)基态Fe原子的价电子轨道表示式(电子排布图)为____,O2-核外电子有___种运动状态。
(2)锂的紫红色焰色是一种_______光谱,LiFePO4中阴离子VSEPR模型名称为______,中心原子的杂化轨道类型为____。
(3)一般情况下,同种物质固态时密度比液态大,但普通冰的密度比水小,原因是____________;H2O2难溶于CS2,简要说明理由:____________________。
(4)Li2O是离子晶体,其晶体能可通过如图甲的Born - Haber循环计算得到。可知,Li2O晶格能为____kJ/mol。

(5)磷化钛熔点高、硬度大,其晶胞如图乙所示。
①磷化钛晶体中Ti原子周围最邻近的Ti数目为____;设晶体中Ti原子与最邻近的P原子之间的距离为r,则Ti原子与跟它次邻近的P原子之间的距离为_______。
②设磷化钛晶体中Ti、P原子半径分别为a pm、b pm,它们在晶体中紧密接触,则该晶胞中原子的空间利用率为_____ (用a、b表示)。
【答案】![]() 10 发射 正四面体 sp3 液态水中分子间相对自由,冰中每个水分子中的氢原子和氧原子共参与形成4个氢键,水分子形成正四面体,分子间距离增大,密度减小 H2O2为极性分子,CS2为非极性分子,根据相似相溶原理,H2O2难溶于CS2 2908 12
10 发射 正四面体 sp3 液态水中分子间相对自由,冰中每个水分子中的氢原子和氧原子共参与形成4个氢键,水分子形成正四面体,分子间距离增大,密度减小 H2O2为极性分子,CS2为非极性分子,根据相似相溶原理,H2O2难溶于CS2 2908 12 ![]() r
r 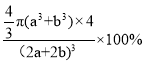
【解析】
(1) Fe的电子排布式是[Ar]3d64s2, O2-核外电子总数为10,其原子核外有10种运动状态不同的电子;
(2)PO43-中P原子价层电子对个数=![]() ,且不含孤电子对,根据价层电子对互斥理论判断该微粒空间构型及P原子的杂化形式;
,且不含孤电子对,根据价层电子对互斥理论判断该微粒空间构型及P原子的杂化形式;
(3) 液态水中分子间相对自由,冰中每个水分子中的氢原子和氧原子共参与形成4个氢键,水分子形成正四面体,使水分子之间间隙增大,密度变小,导致固态H2O的密度比其液态时小, H2O2为极性分子,而CS2为非极性溶剂,根据“相似相溶”规律可知;
(4) 晶格能是气态离子形成1mol离子晶体释放的能量
(5) ①有一个Ti原子位于体心,在三维坐标中,体心Ti原子可以形成3个面,每一个形成的面上有4个Ti原子;由晶胞的截图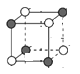 可知,顶点Ti原子与小立方体顶点P原子最邻近,与体对角线的P原子次近邻;
可知,顶点Ti原子与小立方体顶点P原子最邻近,与体对角线的P原子次近邻;
②磷化钛晶胞为面心立方密堆积,晶胞中P原子位于顶点和面心上,Ti位于棱边上和体内,利用均摊法计算。
(1) Fe的电子排布式是[Ar]3d64s2,价电子轨道表示式(电子排布图)为![]() ,故答案为:
,故答案为:![]() ; O2-核外电子总数为10,其原子核外有10种运动状态不同的电子,故答案为10;
; O2-核外电子总数为10,其原子核外有10种运动状态不同的电子,故答案为10;
(2)紫红色波长介于380-435nm之间,是一种发射光谱,故答案为:发射;PO43-中P原子价层电子对个数=![]() ,且不含孤电子对,据价层电子对互斥理论判断该微粒VSEPR模型为正四面体形、P原子的杂化形式为sp3;故答案为正四面体、sp3;
,且不含孤电子对,据价层电子对互斥理论判断该微粒VSEPR模型为正四面体形、P原子的杂化形式为sp3;故答案为正四面体、sp3;
(3) 液态水中分子间相对自由,冰中每个水分子中的氢原子和氧原子共参与形成4个氢键,水分子形成正四面体,使水分子之间间隙增大,密度变小,导致固态H2O的密度比其液态时小,故答案为:液态水中分子间相对自由,冰中每个水分子中的氢原子和氧原子共参与形成4个氢键,水分子形成正四面体,分子间距离增大,密度减小; H2O2为极性分子,而CS2为非极性溶剂,根据“相似相溶”规律可知,H2O2难溶于CS2,
故答案为:H2O2为极性分子,CS2为非极性分子,根据相似相溶原理,H2O2难溶于CS2;
(4) 图中: 2Li(晶体)+1/2O2(g)=Li2O(晶体)的△H=-598KJ·mol1 ,Li原子的第一电离能为Li原子失去1个电子所需要的能量,所以其第一电离能为1040/2kJ·mol-1=520kJ·mol-1;O=O键键能为氧气分子变为氧原子所需能量,其键能=2×249kJ·mol-1=498kJ·mol-1;晶格能是气态离子形成1mol离子晶体释放的能量,所以其晶格能为2908kJ·mol-1,故答案为:2908;
(5) ①根据磷化钛晶体可知,有一个Ti原子位于体心,在三维坐标中,体心Ti原子可以形成3个面,每一个形成的面上有4个Ti原子,则该Ti原子最邻近的Ti的数目为3×4=12个;由晶胞的截图 可知,顶点Ti原子与小立方体顶点P原子最邻近,与体对角线的P原子次近邻,Ti原子与跟它最邻近的P原子之间的距离为r,则跟它次邻近的P原子之间的距离为
可知,顶点Ti原子与小立方体顶点P原子最邻近,与体对角线的P原子次近邻,Ti原子与跟它最邻近的P原子之间的距离为r,则跟它次邻近的P原子之间的距离为![]() =
=r,故答案为:12;
![]() r;
r;
②磷化钛晶胞为面心立方密堆积,晶胞中P原子位于顶点和面心上,Ti位于棱边上和体内,每个晶胞中含有的P原子个数为8×![]() +6×
+6×![]() =4,含有的Ti原子个数为 12×
=4,含有的Ti原子个数为 12×![]() +1=4,P原子和Ti原子的体积之和为
+1=4,P原子和Ti原子的体积之和为![]() π(a+b)3×4 pm3,晶胞的边长(2a+2b)pm,体积为(2a+2b)3pm3,则在磷化钛晶体中原子的空间利用率为
π(a+b)3×4 pm3,晶胞的边长(2a+2b)pm,体积为(2a+2b)3pm3,则在磷化钛晶体中原子的空间利用率为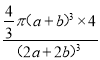 ×100%,故答案为:
×100%,故答案为: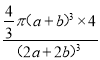 ×100%;
×100%;


科目:高中化学 来源: 题型:
【题目】下列的图示与对应的叙述相符的是( )
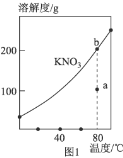
A.图1表示![]() 的溶解度曲线,图中a点表示的溶液通过升温可以得到b点
的溶解度曲线,图中a点表示的溶液通过升温可以得到b点
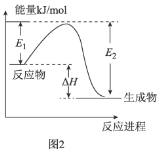
B.图2表示某一放热反应,若使用催化剂![]() 、
、![]() 、
、![]() 都会发生改变
都会发生改变
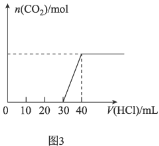
C.图3表示向![]() 和
和![]() 的混合溶液中滴加稀盐酸时,产生
的混合溶液中滴加稀盐酸时,产生![]() 的情况
的情况
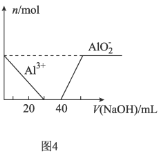
D.图4表示向![]() 的
的![]() 和
和![]() 的
的![]() 混合溶液中滴加
混合溶液中滴加![]() 的
的![]() 溶液时
溶液时![]() 和
和![]() 的变化情况
的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律在生产和科学研究中有很重要的意义。已知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,放出了X kJ热量。已知碳完全燃烧的焓变△H= 一Y kJ·mol-1,则lmol C与O2反应生成CO的反应热△H为 ( ) kJ·mol-1
A.一Y B.—(10X—Y) C.一(5X—O.5Y) D.+(10X—Y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂是重要的营养物质.某天然油脂A可发生下列反应:

已知:A的分子式为C57H106O6.1mol该天然油脂A经反应①可得到1molD、1mol不饱和脂肪酸B和2mol直链饱和脂肪酸C.经测定B的相对分子质量为280,原子个数比为C:H:O=9:16:1;
(1)写出B的分子式:________________________;
(2)写出反应①的反应类型:____________;C的名称(或俗称)是_________;
(3)近日,电视媒体关于“氢化油危害堪比杀虫剂”的报道引发轩然大波,反应②为天然油脂的氢化过程.下列有关说法不正确的是_______________;
a.氢化油又称人造奶油,通常又叫硬化油.
b.植物油经过氢化处理后会产生副产品反式脂肪酸甘油酯,摄入过多的氢化油,容易堵塞血管而导致心脑血管疾病.
c.氢化油的制备原理是在加热植物油时,加入金属催化剂,通入氢气,使液态油脂变为半固态或固态油脂.
d.油脂的氢化与油脂的皂化都属于加成反应
(4)D和足量金属钠反应的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。

①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如右所示。下列关于分枝酸的叙述正确的是

A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1 mol分枝酸分子中含2mol—OH(羟基)
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸氢钠是重要的化工产品。用标准盐酸溶液滴定可测定碳酸氢钠样品中碳酸氢钠含量。已知碳酸氢钠受热易分解,且在250℃~270℃分解完全。
完成下列填空:
(1)测定碳酸氢钠含量的实验步骤:用电子天平称取碳酸氢钠样品(准确到_____g),加入锥形瓶中,加入使之完全溶解;加入甲基橙指示剂,用标准盐酸溶液滴定。当滴定至溶液由_____色变为_____色,半分钟不变色为滴定终点,记录读数。该实验不能用酚酞作指示剂的原因是_____。
(2)若碳酸氢钠样品质量为0.840g,用0.5000mol/L的标准盐酸溶液滴定至终点,消耗标准盐酸溶液19.50mL。样品中NaHCO3的质量分数为_____(保留3位小数)。
(3)如果滴定尖嘴部分在滴定过程中出现气泡,且滴定终点读数时气泡未消失,会导致测定结果____(选填“偏高”、“偏低”或“不受影响”)。
(4)碳酸氢钠样品含有少量水分(<0.5%)和氯化钠。以下是测定碳酸氢钠样品中水分的实验方案(样品中NaHCO3含量已知)。
①在恒重的坩埚中称取碳酸氢钠样品,样品和坩埚的质量为m1g。
②将样品和坩埚置于电热炉内,在250℃~270℃加热分解至完全,经恒重,样品和坩埚的质量为m2g。
③……。
该实验方案中,质量差(m1-m2)是_____的质量。若所称取样品中NaHCO3的质量为m3g,则样品中水分的质量m=_____(用含m、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ是NO2(g)+CO(g) ![]() CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。
CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。

下列有关说法正确的是
A. 一定条件下,向密闭容器中加入1 mol NO2(g)与1 mol CO(g)反应放出234 kJ热量
B. 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C. 若X表示温度,则Y表示的可能是CO2的物质的量浓度
D. 若X表示反应时间,则Y表示的可能是混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在用稀硫酸与过量的锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是___________________;并用简单的装置图来表明你所阐述的理由______________________________;
(2)要加快上述实验中气体产生的速率,还可采取的措施有_______________;
(3)下列物质的加入能减慢氢气生成速率但不影响生成氢气的体积的是_____
A.加入碳酸钠溶液 B.加入硫酸钠溶液
C.加入硝酸钠溶液 D.加入醋酸钠溶液
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到 6 个盛有过量 Zn 粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
混合溶液实验 | 1 | 2 | 3 | 4 | 5 | 6 |
4mol·mol-1H2SO4/mL | 40 | V1 | V2 | V3 | V4 | V5 |
饱和 CuSO4 溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V6、V8 分别是_____________;
②该同学最后得出的结论为:当加入少量 CuSO4 溶液时,生成氢气的速率会大大提高,随着加入的 CuSO4 溶液增多时,生成氢气的速率会______(填加快、减慢或不变)。理由___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com