
����Ŀ��Ti��Fe��Cr��Mn�Ⱦ�Ϊ����Ԫ�أ����������������Ų����������Ҫ���ã����䵥�ʺͻ������Ӧ���о���Ŀǰ��ѧ�о���ǰ��֮һ����ش��������⣺
��1��CrԪ�صĻ�̬ԭ�ӵ����Ų�ʽΪ_____________________���Ƚ�Fe��Mn�ĸ��������ܺ��֣���̬Mn2+��ʧȥһ�����ӱ���̬Fe2+��ʧȥһ������______����ѡ����ס�����
��2��CuԪ�ش������ڱ�____________������ʢ������ͭ���Թ�����백ˮ�������γ���ɫ�������������백ˮ�������ܽ⣬��ʱ�����ӷ���ʽΪ______________���������Ҵ�������____________ɫ�ľ��壬�������ӵ����ӹ���Ϊ_____________
��3��ij���������������ͼ1������Aԭ��Ϊ�����Ķ��㣬Aλ������Ca��Sr��Ba��Pb����Bλ��V��Cr��Mn��Feʱ�����ֻ��������CMRЧӦ���ŵ���ЧӦ������A��B��O��ʾ�������⾧��Ļ�ѧʽ��_____________��
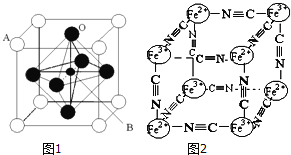
��4����һ����ɫ����ɱ�ʾΪ��[KxFey(CN)z]���о��������Ľṹ������Fe2+��Fe3+�ֱ�ռ��������Ķ��㣬�����������ڣ���CN-λ������������ϣ�K+λ�������������ģ���K+��ȱ��Ϊ50%��������û��K+��ռ�����ĵİٷֱȣ����侧���е������Ӿ����ṹ����ͼ��ͼ2��ʾ���þ���Ļ�ѧʽ�ɱ�ʾΪ____________��
���𰸡� 1s22s22p63s23p63d54s1 �� ds Cu(OH)2��4NH3=[Cu(NH3)4]2����2OH�� ���� ƽ���ı��� ABO3 KFe2(CN)6
�����������⿼��ѡ���������ʽṹ�����ʡ�����1��Crλ�ڵ�������VIB�壬���Cr�����Ų�ʽΪ[Ar]3d54s1����1s22s22p63s23p63d54s1��Mn2���ĵ����Ų�ʽΪ[Ar]3d5��d�ܼ����ڰ���״̬��Fe2���ĵ����Ų�ʽΪ[Ar]3d6���ܼ��ϵĵ��Ӵ��ڰ�����ȫ����ȫ�յ�����ȶ��������̬Mn2����ʧȥһ�����ӱ���̬Fe2����ʧȥһ�������ѣ���2��ͭԪ�صļ۵����Ų�ʽΪ3d104s1��λ��IB�壬����ds������ɫ������Cu(OH)2 ���������백ˮ�������ܽ⣬������Ϸ�Ӧ�����ӷ���ʽΪCu(OH)2��4NH3=[Cu(NH3)4]2����2OH�����������İ���ͭ�������Ҵ�����Ϊ������������������ɫΪ����ɫ���������ӵ����ӹ���Ϊƽ���ı��Σ���3�����ݾ����ľ�̯����Aλ�ھ����Ķ��㣬����Ϊ8��1/8=1��Bλ�����ģ�ȫ�����ھ�����Oλ�����ģ�����Ϊ6��1/2=3����˻�ѧʽΪABO3����4�����ݾ����Ľṹ��Fe2��λ�ڶ��㣬����Ϊ4��1/8=1/2��Fe3��λ�ڶ��㣬����Ϊ4��1/8=1/2��CN��λ�����ϣ�����Ϊ12��1/4=3��K����ȱ��Ϊ50%��������������һ��K������һ��������K���ĸ���Ϊ1/2����ѧʽΪK[Fe2(CN)6]��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ����ѧϰС�鷢�ֽ�þ�۰�ͼͶ�봿ˮ���������ԣ���Ͷ���Ȼ����Һ�У���������������Ӧ�������������ݡ�������ù��̲����������壬����һ�������д̼�����ζ��

��1��ʵ�鿪ʼʱ��У����pH�������ⶨ��ˮ��pH�����ִ�ˮ��pH������7.30���ң���ԭ�������_____________________
��2������Ƽ�ʵ�鷽����������ʵ�����д̼�����ζ�����壺__________________
��3��ʵ����0.2mol/L�Ȼ����Һ��pHΪ5.90���������ӷ���ʽ����ԭ��_________________
��4����С��ͬѧΪ̽��þ���Ȼ����Һ��Ӧ��ԭ�����������ʵ�鷽����
��� | ʵ���Լ� | ʵ������ | |
ʵ��1-1 | 0.20gþ�� | 3.0mL 0.2mol/LNH4Cl��Һ | ��Ӧ���ԣ������ݲ��� |
ʵ��1-2 | 0.20gþ�� | 3.0mL���� | ��Ӧ�����ԣ�����û�����ݲ��� |
������̽��ʵ��1-2ѡ�õ�����Ϊ_____________(����ĸ)��
A��1 mol��L��1 B��pH��1.0 C��0.2 mol��L��1 D��pH��5.90
��ͨ��ʵ��Աȣ�˵��NH4Cl ˮ�������H+ �Է�ӦӰ��_____NH4+ �Է�ӦӰ�죨�С�ڡ��������ڡ����ڡ�����
��5����С��ͬѧ����̽��þ�����Ȼ����Һ��Ӧ���ҵ�Ӱ�����ء�
ʵ����� | ʵ���Լ� | |
ʵ��2-1 | 0.20gþ�� | ________________ |
ʵ��2-2 | 0.20gþ�� | _________________ |
ʵ��3-1 | 0.20gþ�� | 3.0mL0.2mol/L NH4NO3��Һ |
ʵ��3-2 | 0.20gþ�� | 3.0mL0.2mol/L KNO3��Һ |
��ʵ��2-1��ʵ��2-2��ʵ������˵��Cl-�Է�Ӧ���ʵ�Ӱ���С���벹�����ʵ�鷽��������Լ���
��ʵ��3-1��ʵ��3-2�Ľ���˵��NH4+�Է�Ӧ����Ӱ��ܴ�����֧�Թ���ʵ������IJ�֮ͬ����___________________
��6��д��þ���Ȼ����Һ��Ӧ����Mg2+�����ӷ���ʽ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾʵ��װ�õ�K�պ�,����������ȷ����

A.Cu�缫�Ϸ�����ԭ��Ӧ
B.������Zn��a��b��Cu·������
C.Ƭ�̺�׳���c��S![]() ������
������
D.Ƭ�̺�ɹ۲쵽��ֽb����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���Ľṹ����������ʽ����ʾ���磺CH3CH=CHCH3�ɼ�дΪ![]() ���л���X�ļ���ʽΪ
���л���X�ļ���ʽΪ ������˵������ȷ����( )
������˵������ȷ����( )
A. X�Ļ�ѧʽΪC8H8
B. �л���Y��X��ͬ���칹�壬�����ڷ���������Y�Ľṹ��ʽΪ![]()
C. X��ʹ�������������Һ��ɫ
D. X��������H2��һ�������·�Ӧ�����ɻ�״�ı�����Z��Z��һ�ȴ�����4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������ɳ�����չ������أ�����˵����ȷ����
A�����������������Դ�ǻ�ѧ��
B��̫������ˮ����������ʹ�á��������Ҵ����漰�������ܵ�����
C�����ö�����̼����ȫ������������Ч���١���ɫ��Ⱦ��
D�����ǿ��ѷ��ȷ�Ӧ�ͷŵ�����ת��Ϊ���������õ������������ȷ�Ӧû�����ü�ֵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ã������ʵ��Լ�������±���̽��ʵ�飬���ó���Ӧ��ʵ����ۣ����д������
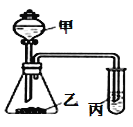
ѡ�� | �� | �� | __�� | װ�ñ��е����� | ʵ����� |
A | ϡ���� | ̼��� | �Μ[ʯ��ˮ | ����� | ���ԣ�HNO3>H2CO3 |
B | ϡ���� | ̼���� | ���������Һ | ��ɫ���� | ���ԣ�H2CO3>HClO |
C | Ũ���� | ����ʯ | ��������Һ | ��ɫ���� | �ǽ����ԣ�C>Si |
D | Ũ���� | ������� | ʯ����Һ | �ȱ�����ɫ | ��ˮ�������ԣ��־���Ư���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ȼ�ϵ����CsHSO4����Ϊ����ʴ���H����������ṹ����ͼ������ܷ�Ӧ�ɱ�ʾΪ2H2��O2===2H2O�������й�˵����ȷ����( )

A������ͨ�����·��b������a��
B��b���ϵĵ缫��ӦʽΪO2��2H2O��4e��===4OH��
C��ÿת��0.1 mol���ӣ�������1.12 L��H2
D��H����a��ͨ�����������ʴ��ݵ�b��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ھ�������β���ķ�Ӧ��2NO(g)+2CO(g)![]() 2CO2(g)+N2(g),��֪�÷�Ӧ���ʼ�����570Kʱƽ�ⳣ��Ϊl��1059������˵����ȷ���ǣ� ��
2CO2(g)+N2(g),��֪�÷�Ӧ���ʼ�����570Kʱƽ�ⳣ��Ϊl��1059������˵����ȷ���ǣ� ��
A��װ��β������װ�õ������ų��������в��ٺ���NO��CO
B�����β������Ч�ʵij��÷����������¶�
C�����β������Ч�ʵ����;�������Ƹ�Ч����
D��570Kʱ�÷�Ӧ������еij̶Ⱥܴ�ʹ�ô�������ʵ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[2016�¿α���]��ѧ������������ء������й�˵���������
A�������յķ����������ֲ�˿��������ά
B��ʳ���ͷ������Ȼ���������������к�����
C��������ɱ�����в�������Ϊ���������ȱ���
D��ҽ�������ƾ����Ҵ���Ũ��Ϊ95%
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com