
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
(1)在一定体积的恒容密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0;其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题:
2NH3(g) △H<0;其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题:
t/K | 298 | 398 | 498 | … |
K/(mol·L-1)2 | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1___________ K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是____________(填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.混合气体中氢气的质量不变
C.容器内压强保持不变 D.混合气体的密度保持不变
③某温度下,在一个10L的固定容器中充入2molN2和4molH2进行如下反应:N2(g)+3H2(g)![]() 2NH3(g);H<0一段时间达平衡后,N2的转化率为50%,求该温度下的平衡常数K=_______________(mol/L)-2 ,平衡时NH3的体积分数为_______。
2NH3(g);H<0一段时间达平衡后,N2的转化率为50%,求该温度下的平衡常数K=_______________(mol/L)-2 ,平衡时NH3的体积分数为_______。
(2)肼(N2H4)高效清洁的火箭燃料。8g气态肼在氧气中完全燃烧生成氮气和气态水,放出133.5kJ热量,则肼燃烧的热化学方程式为_____________________。
【答案】> ABC 400 50% N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol
【解析】
(1)①升高温度,平衡逆向移动,K减小。
②根据判断平衡状态的方法进行分析。
③ 根据是三段式分析并进行计算。
(2)根据1mol气态肼32g计算在氧气中完全燃烧生成氮气和气态水,放出的热量,并写出热化学方程式。
(1)①升高温度,平衡逆向移动,K减小,因此K1、K2的大小:K1>K2,故答案为:>。
②A选项,2v(H2)(正)=3v(NH3)(逆)符合一正一逆,速率之比等于计量系数之比,故A符合题意;
B选项,氢气量开始减少,当混合气体中氢气的质量不变,能判断达到平衡,故B符合题意;
C选项,该反应是体积减小的反应,容器内压强保持不变,达到平衡,故C符合题意;
D选项,气体质量不变,容器体积不变,因此混合气体的密度始终保持不变,不能判定达到平衡状态,故D不符合题意;
综上所述,答案为ABC。
③ N2(g) + 3H2(g)![]() 2NH3(g)
2NH3(g)
开始:2mol 4mol 0
转化:1mol 3mol 2mol
平衡:1mol 1mol 2mol
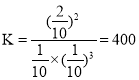 ,
,![]() ;
;
故答案为:400;50%。
(2)8g气态肼(物质的量为0.25mol)在氧气中完全燃烧生成氮气和气态水,放出133.5kJ热量,则肼燃烧的热化学方程式为N2H4(g) + O2(g) = N2(g) +2H2O(g) ΔH = -534kJ/mol;
故答案为:N2H4(g) + O2(g) = N2(g) +2H2O(g) ΔH =-534kJ/mol。


科目:高中化学 来源: 题型:
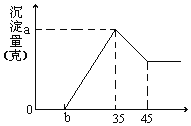
【题目】准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL 稀H2SO4溶液的烧杯中,充分反应后过滤去掉沉淀,向滤液中加入10mol/L的NaOH溶液,产生沉淀的质量和加入的NaOH溶液的体积(mL)如图所示。试回答下列问题:
(1)硫酸溶液的物质的量浓度。___
(2)若b=2.3时,求Al2O3和Fe2O3的质量分数。___、___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是常见的单质,其中甲、乙、丙是摩尔质量依次增加的气体。A和B以物质的量2︰1通入水中,得到C溶液。请根据下图的转化关系回答:
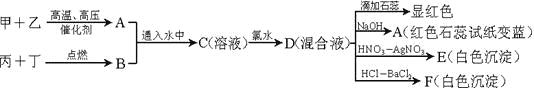
(1)用方程式解释A使湿润的红色石蕊试纸变蓝的原因___________________
(2)写出溶液C中加氯水的离子方程式___________________
(3)若A和B按1:1通入水中反应,写出反应方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污水处理是保护环境的需要,是每家企业应尽的义务。
已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
(1)还原法:在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
![]()
有关离子完全沉淀的pH如下表:
有关离子 | Fe2+ | Fe3+ | Cr3+ |
完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
①写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式_____。
②还原+6价铬还可选用以下的试剂_____(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
③在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
在操作②中调节pH应分2次进行,第1次应先调节溶液的pH范围约在____(填序号)最佳,第2次应调节溶液的pH范围约在____(填序号)最佳。
A.3~4 B.6~8 C.10~11 D.12~14
用于调节溶液pH的最佳试剂为:____(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
(2)电解法:将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
④写出阴极的电极反应式_____。
⑤电解法中加入氯化钠的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,能够表示物体燃烧热的是( )
A.C(s)+![]() O2(g)=CO(g);
O2(g)=CO(g);![]() ΔH=-110.5kJ/mol
ΔH=-110.5kJ/mol
B.H2(g)+Cl2(g)=2HCl(g);![]() ΔH=-184.6kJ/mol
ΔH=-184.6kJ/mol
C.H2(g)+![]() O2(g)=H2O(g);
O2(g)=H2O(g);![]() ΔH=-241.8kJ/mol
ΔH=-241.8kJ/mol
D.C8H18(g)+![]() O2(g)=8CO2(g)+9H2O(l);ΔH=-5518kJ/mol
O2(g)=8CO2(g)+9H2O(l);ΔH=-5518kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制氢气的一个重要反应是:CO(g)+H2O(g)![]() CO2(g)+H2(g)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡状态所需时间/min | ||
CO | H2O | H2 | CO2 | |||
I | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
II | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
①对于反应CO(g)+H2O(g)![]() CO2(g)+H2(g),下列说法正确的是_________
CO2(g)+H2(g),下列说法正确的是_________
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态
B.若混合气体的密度不再改变,说明该反应已达化学平衡状态
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,H2的体积分数增大
D.若使用催化剂,会改变反应的途径,但反应的焓变不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率v(CO)=_________ ;
③实验II条件下反应的平衡常数K=_________ (保留小数点后二位);H2O(g)的平衡转化率为_______。
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1.5molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则平衡向______方向移动(填“正反应”、“逆反应”或“不移动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应2X(g)+3Y(g)![]() 4Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.2mol·L-1、0.3 mol·L-1、0.16 mol·L-1,则下列判断不合理的是
4Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.2mol·L-1、0.3 mol·L-1、0.16 mol·L-1,则下列判断不合理的是
A.c1∶c2=2∶3
B.X、Y的转化率不相等
C.平衡时,Y和Z的生成速率之比为3∶4
D.c1的取值范围为0<c1<0.28 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 构成原电池的两个电极必须是活泼性不同的两种金属
B. 下图原电池中,电流由锌棒经外电路流向铜棒

C. 通过构成原电池,能将反应的化学能全部转化为电能
D. 银锌纽扣电池的放电反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中的离子反应在许多领域都有广泛的应用,请回答下列问题。
(1)在配制氯化铁溶液时,常常会出现浑浊,可以加入少量的__________防止上述问题。
(2)明矾具有净水的作用,原因是:___________________________(用离子方程式表示)。
(3)将25 ℃时pH=12的NaOH溶液a L与pH=1的HCl溶液b L混合。若所得混合液为中性,则a∶b=______________。
(4)加热蒸干AlCl3溶液并灼烧所得固体,最终得到的产物是______________
(5)常温下,已知Ksp[M(OH)3] =1.0×1038,要使溶液中的M3+降至105mol/L,则应调节溶液pH=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com