
【题目】甲、乙、丙、丁是常见的单质,其中甲、乙、丙是摩尔质量依次增加的气体。A和B以物质的量2︰1通入水中,得到C溶液。请根据下图的转化关系回答:
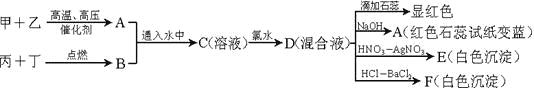
(1)用方程式解释A使湿润的红色石蕊试纸变蓝的原因___________________
(2)写出溶液C中加氯水的离子方程式___________________
(3)若A和B按1:1通入水中反应,写出反应方程式_________________。
【答案】NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH- SO32-+Cl2+H2O =SO42-+2Cl-+2H+ SO2+NH3+H2O=NH4HSO3
NH4++OH- SO32-+Cl2+H2O =SO42-+2Cl-+2H+ SO2+NH3+H2O=NH4HSO3
【解析】
D的混合液中滴加石蕊试液,溶液显红色,说明溶液显酸性;加入NaOH溶液有使湿润红色石蕊试纸变蓝的气体,说明D溶液中含有NH4+;加入稀硝酸酸化后,再滴加AgNO3溶液,有白色沉淀生成,说明溶液中含有Cl-;加入盐酸酸化,再滴加BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42-;C溶液中通入氯水得到D溶液,再结合甲和乙生成A的反应条件,丙和丁点燃条件下生成B,并结合甲、乙、丙、丁是常见的单质,其中甲、乙、丙是摩尔质量依次增加的气体;A和B以物质的量2︰1通入水中,得到C溶液。可知甲为H2、乙为N2、丙为O2,丁为S,A为NH3、B为SO2,C溶液为(NH4)2SO3溶液,C中通入氯水后所得的D溶液中含有SO42-、Cl-、NH4+,据此分析解题。
(1)由分析知A为NH3,因其电离使水溶液显碱性,使湿润的红色石蕊试纸变蓝,发生反应的方程式和电离方程式为NH3 + H2O ![]() NH3·H2O
NH3·H2O![]() NH4++OH-;
NH4++OH-;
(2) C溶液为(NH4)2SO3溶液,C中通入氯水后所得的D溶液中含有SO42-、Cl-、NH4+,发生反应的离子方程式为SO32-+Cl2+H2O =SO42-+2Cl-+2H+;
(3) NH3和SO2按1:1通入水中生成NH4HSO3,发生反应的方程式为SO2+NH3+H2O=NH4HSO3。


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物(10e或18e)在常温下均为气态,在元素周期表中Z与W相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的外成层电子数相同。
(1)Z离子的结构示意图是_____________________________。
(2)X、Y、W可组成一种化合物,原子个数比为4:1:1,该化合物的化学式是_______,其中含有的化学键有__________________。
(3)X与Y所形成的分子的电子式为__________,它比同主族其他元素的氢化物沸点高的原因是__________________。
(4)请从Z、W的结构上说明Z、W两种元素非金属性的强弱_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3molSO2和1 molO2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+ O2(g)![]() 2SO3(g) △H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
2SO3(g) △H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
A.SO2与O2的转化率可能相等
B.容器中一定存在n(SO2)>1mol且n(SO3)<2mol
C.放出的热量为197kJ
D.当O2的转化率为50%时SO2和SO3 的物质的量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的相对分子质量比D的相对分子质量大16,在一定条件下,各物质相互转化关系如下图所示。

请按要求填空:
(1)丙的化学式是_______,G的化学式是_________。
(2)写出有关变化的化学方程式:甲 + 乙:___________;D + 丙:_______。
(3)B与X的水溶液反应生成C和乙的离子方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,把0.5molN2O4通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系己达平衡,此时容器内压强为开始时的1.6 倍。下列说法正确的是( )
A.前2s以N2O4的浓度变化表示的平均反应速率为0.01mol·L-1·s-1
B.在平衡时体系内N2O4的物质的量为0.25mol
C.在2s时体系内的压强为开始时的1.1倍
D.平衡时,N2O4的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.Na在足量O2中燃烧,消耗lmol O2时转移的电子数是4×6.02×1023
B.盐酸和醋酸的混合溶液pH=1,该溶液中c(H+) =0.1 mol/L
C.1 L 0.1 mol/L NH4Cl溶液中的NH![]() 数是0.1×6.02×1023
数是0.1×6.02×1023
D.标准状况下2.24 L Cl2中含有0.2 mol 共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸(H3PO4)是一种中强酸,常温下,H3PO4水溶液中含磷微粒的分布分数(平衡时某微粒的浓度占各含磷微粒总浓度的分数)与pH的关系如图,下列说法正确的是( )


A.H3PO4的电离方程式为:H3PO4![]() 3H++PO43-
3H++PO43-
B.pH=2时,溶液中大量存在的微粒有:H3PO4、H2PO4-、HPO42-、PO43-
C.滴加NaOH溶液至pH=7,溶液中c(Na+)=c(H2PO4-)+2c(HPO42-)+3c(PO43-)
D.滴加少量Na2CO3溶液,3Na2CO3+2H3PO4=2Na3PO4+3H2O+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
(1)在一定体积的恒容密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0;其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题:
2NH3(g) △H<0;其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题:
t/K | 298 | 398 | 498 | … |
K/(mol·L-1)2 | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1___________ K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是____________(填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.混合气体中氢气的质量不变
C.容器内压强保持不变 D.混合气体的密度保持不变
③某温度下,在一个10L的固定容器中充入2molN2和4molH2进行如下反应:N2(g)+3H2(g)![]() 2NH3(g);H<0一段时间达平衡后,N2的转化率为50%,求该温度下的平衡常数K=_______________(mol/L)-2 ,平衡时NH3的体积分数为_______。
2NH3(g);H<0一段时间达平衡后,N2的转化率为50%,求该温度下的平衡常数K=_______________(mol/L)-2 ,平衡时NH3的体积分数为_______。
(2)肼(N2H4)高效清洁的火箭燃料。8g气态肼在氧气中完全燃烧生成氮气和气态水,放出133.5kJ热量,则肼燃烧的热化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:

(1)甲池为__________(填原电池、电解池或电镀池),通入甲醇电极的电极反应式 为______________________________________________。
(2)乙池中B电极为______(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应化学方程式为__________________________________________。
(3)当乙池中B极质量增重5.4g时,甲池中理论上消耗O2的体积为______mL(标准状况)。
(4)丙池中,C上的电极反应式为____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com