
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:

(1)甲池为__________(填原电池、电解池或电镀池),通入甲醇电极的电极反应式 为______________________________________________。
(2)乙池中B电极为______(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应化学方程式为__________________________________________。
(3)当乙池中B极质量增重5.4g时,甲池中理论上消耗O2的体积为______mL(标准状况)。
(4)丙池中,C上的电极反应式为____________________________________。
【答案】原电池 CH3OH-6e -+8OH-=CO32- +6H2O 阴极 4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3 280 4OH--4e-=2H2O+O2
4Ag+O2↑+4HNO3 280 4OH--4e-=2H2O+O2![]()
【解析】
由装置图可知甲池为原电池,CH3OH燃料做负极,负极失电子发生氧化反应,在碱性溶液中生成碳酸盐,乙、丙为电解池,乙池中A为阳极,B为阴极,电池中是电解硝酸银溶液生成单质银,丙池中D为阴极,C为阳极,阳极上溶液中的OH-失电子发生氧化反应。以此进行判断。
(1)甲池为原电池,燃料在负极失电子发生氧化反应,在碱性溶液中生成碳酸盐,甲池中通入CH3OH电极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O;答案:原电池;CH3OH-6e-+8OH-=CO32-+6H2O;
(2)乙池是电解池,A为阳极,B为阴极,电池中是用惰性电极电解硝酸银溶液,阳极是水电离的氢氧根离子失电子生成氧气,阴极是银离子得到电子生成单质银,电池的总反应方程式为:4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3;答案:阴极;4AgNO3+2H2O
4Ag+O2↑+4HNO3;答案:阴极;4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3;
4Ag+O2↑+4HNO3;
(3)乙池中B极是阴极,银离子得电子生成银,物质的量n=![]() =0.05mol,依据电子守恒计算4Ag~O2~4e-,所以甲池中理论上消耗O2的物质的量为0.0125mol,标况下体积0.0125mol
=0.05mol,依据电子守恒计算4Ag~O2~4e-,所以甲池中理论上消耗O2的物质的量为0.0125mol,标况下体积0.0125mol![]() 22.4L/mol=0.28L=280mL;答案:280;
22.4L/mol=0.28L=280mL;答案:280;
(4)丙池为电解硫酸铜溶液,D为阴极,C为阳极,阳极上溶液中的OH-失电子发生氧化反应,其电极反应式为4OH--4e-=2H2O+O2↑,答案:4OH--4e-=2H2O+O2![]() 。
。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是常见的单质,其中甲、乙、丙是摩尔质量依次增加的气体。A和B以物质的量2︰1通入水中,得到C溶液。请根据下图的转化关系回答:
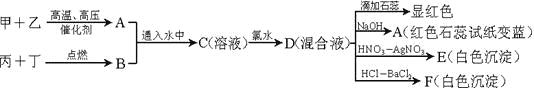
(1)用方程式解释A使湿润的红色石蕊试纸变蓝的原因___________________
(2)写出溶液C中加氯水的离子方程式___________________
(3)若A和B按1:1通入水中反应,写出反应方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应2X(g)+3Y(g)![]() 4Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.2mol·L-1、0.3 mol·L-1、0.16 mol·L-1,则下列判断不合理的是
4Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.2mol·L-1、0.3 mol·L-1、0.16 mol·L-1,则下列判断不合理的是
A.c1∶c2=2∶3
B.X、Y的转化率不相等
C.平衡时,Y和Z的生成速率之比为3∶4
D.c1的取值范围为0<c1<0.28 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 构成原电池的两个电极必须是活泼性不同的两种金属
B. 下图原电池中,电流由锌棒经外电路流向铜棒

C. 通过构成原电池,能将反应的化学能全部转化为电能
D. 银锌纽扣电池的放电反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)BN是一种新型无机材料,由于_________与_________属于等电子体物质,其结构和性质具有极大的相似性,则可推知,在BN的两种晶型中,一种是类似_________的空间网状结构晶体,可用作耐磨材料,另一种是类似于__________的层状结构的混合型晶体,可用作润滑材料,在其结构的每一层上最小的封闭环中有_________个B原子,B—N键角为_________
(2)单质硼有无定形和晶体两种,参考表中数据:
金刚石 | 晶体硅 | 晶体硼 | |
熔点(K) | 3823 | 1683 | 2573 |
沸点(K) | 5100 | 2628 | 2823 |
硬度(M06) | 10 | 7.0 | 9.5 |
①晶体硼的晶体类型属于__________晶体,理由是_______________
②已知晶体硼的基本结构单元是由硼原子组成的正二十面体,如图所示其中20个等边三角形的面和一定数目的顶点,每个顶点上各有1个硼原子。通过观察图形及推算,此基本结构单元由_________个硼原子构成,其中B—B键的键角为___________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸、明矾和硫酸钾组成的混合溶液中,c(Al3+)=0.4 mol·L-1,c(SO42-)=0.8mol·L-1, 水电离的c(H+)=10-13 mol·L-1,则c(K+)为( )
A.0.15 mol·L-1B.0.2 mol·L-1C.0.3 mol·L-1D.0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>CB. 原子序数:d>c>b>a
C. 离子半径:C>D>B>AD. 单质的还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中的离子反应在许多领域都有广泛的应用,请回答下列问题。
(1)在配制氯化铁溶液时,常常会出现浑浊,可以加入少量的__________防止上述问题。
(2)明矾具有净水的作用,原因是:___________________________(用离子方程式表示)。
(3)将25 ℃时pH=12的NaOH溶液a L与pH=1的HCl溶液b L混合。若所得混合液为中性,则a∶b=______________。
(4)加热蒸干AlCl3溶液并灼烧所得固体,最终得到的产物是______________
(5)常温下,已知Ksp[M(OH)3] =1.0×1038,要使溶液中的M3+降至105mol/L,则应调节溶液pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.10 mol·L-1NaOH溶液分别滴定20.00 mL 0.10 mol·L-1HCl溶液和20.00 mL 0.10 mol·L-1CH3COOH溶液,得到2条滴定曲线,如下图所示,则下列说法正确的是
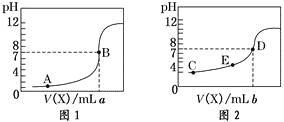
A.图2是滴定盐酸的曲线
B.a与b的关系是:a<b
C.E点对应离子浓度由大到小的顺序为: c(CH3COO-) >c(Na+) >c(H+) >c(OH-)
D.这两次滴定都可以用甲基橙作为指示剂且颜色变化为红变橙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com