
【题目】用下列实验装置进行的实验,能达到相应实验目的是( ) 
A.装置甲:收集NO2气体
B.装置乙:验证X溶液为浓硫酸
C.装置丙:验证氨气在水中的溶解性
D.装置丁:用于吸收尾气NH3
科目:高中化学 来源: 题型:
【题目】某硫酸工业废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等。回收废渣中金属元素的工艺流程如下:
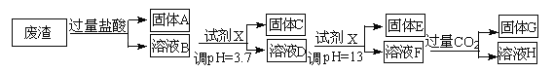
已知常温条件下:
①阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol·L-1 )时的pH 如下表所
示。
阳离子 | Fe3+ | Al3+ | Mg2+ |
开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
恰好完全沉淀时的pH | 3.2 | 5.2 | 11.0 |
②饱和氨水溶液中c(OH-)约为1×10-3mol·L-1。
请回答下列问题:
(1)固体C为_________(填化学式)。
(2)上述流程中两次使用试剂X,试剂X是_________(填“氨水”或“氢氧化钠”),其理由是_________________。
(3)溶液D→固体E的过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是________________。
(4)写出溶液F→溶液H 的离子方程式:__________________。
(5)Ksp[Mg (OH )2]=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4SO3)、硫代硫酸(H2S2O3)等等,在工业上有广泛的应用.它们对应的钠盐同样也是重要的化工产品.
(1)(一).硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解.工业上常利用含硫废水生产Na2S2O35H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程.
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
①烧瓶A中发生反应的离子方程式为: . 装置D的作用是 .
②装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 .
a.蒸馏水 b.饱和Na2SO3溶液c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
③反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有 .
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
④为了保证硫代硫酸钠的产量,实验中通入SO2不能过量,原因是 .
(2)(二)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.Na2S2O5溶于水即生成NaHSO3 . ①证明NaHSO3溶液中HSO3﹣的电离程度大于水解程度,可采用的实验方法是(填序号).
a.测定溶液的pH b.加入Ba(OH)2溶液c.加入盐酸d.加入品红溶液 e.用蓝色石蕊试纸检测
②葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
葡萄酒样品100.00mL ![]() 馏分
馏分 ![]() 溶液出现蓝色且30s内不褪色
溶液出现蓝色且30s内不褪色
方程式为SO2+I2+2H2O=H2SO4+2HI)按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为gL﹣1 . 上述实验过程中,若有部分HI被空气氧化,则测得结果(填“偏高”“偏低”或“不变”).其原因是(用化学方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)N2(g)+2CO2(g).请回答下列问题:
(1)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(NO)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的 ![]() .
.
①该反应的平衡常数K=(用只含a、V的式子表示)
②判断该反应达到平衡的标志是(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(2)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:
①有害气体NO的转化率是 , 0~15minCO2的平均反应速率v(CO2)= . (保留小数点后三位)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 . (填序号).
A.增加CO的量 B.加入催化剂C.减小CO2的量 D.扩大容器体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)下列物质含有离子键的是
A.H2
B.CO2
C.NH3
D.NaOH
(2)下列物质中含有共价键的离子化合物是
A.H2O
B.CaCl2
C.NH4Cl
D.HCl
(3)NaCl、NH3的电子式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如下图所示。下列有关麦考酚酸说法正确的是( )
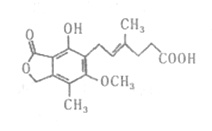
A. 分子式为C17H23O6
B. 不能与FeC13溶液发生显色反应
C. 在一定条件下可发生加成、取代、消去反应
D. l mol麦考酚酸最多能与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.
(1)Ni2+基态核外电子排布式为 .
(2)ClO4﹣的空间构型是;与ClO4﹣互为等电子体的一种分子为(填化学式).
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2 , 碳酰肼中碳原子的杂化轨道类型为;1molCO(N2H3)2分子中含有σ键数目为 .
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成.NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为a,Ni2+的配位数为b,NiO晶体中每个镍离子距离最近的镍离子数目为c,则a:b:c= . 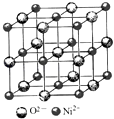
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com