
| 实验编号 | 盐酸体积( mL ) | 标准NaOH溶液的体积(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
 ,判断不当操作对n、V的影响,进而判断溶液浓度的变化;
,判断不当操作对n、V的影响,进而判断溶液浓度的变化; ,判断不当操作对相关物理量的影响;
,判断不当操作对相关物理量的影响; 计算.
计算. mL=17.0mL,
mL=17.0mL,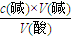 =
= =0.425mol/L,
=0.425mol/L, 分析操作对溶质的物质的量或对溶液的体积的影响判断.
分析操作对溶质的物质的量或对溶液的体积的影响判断. 

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 实验编号 | 盐酸体积( mL ) | 标准NaOH溶液的体积(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(一)在配制物体的量浓度溶液时,下列操作出现的后果是(填: “偏低”、“偏高”、“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体。 。
(2)配制氯化钠溶液时,容量瓶中有少量水。 。
(3)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线。 。
(二)实验室常用标准NaOH溶液测定未知盐酸溶液的浓度。
(1)配制0.5mol·L-1NaOH溶液250mL所需的玻璃仪器为 。
(2)用滴定管准确量取20.00毫升未知浓度盐酸于锥形瓶中, 加入酚酞作指示剂, 用NaOH溶液滴定到终点。
某学生进行了三次实验,实验数据如下表:
| 实验编号 | 盐酸体积( mL ) | 标准NaOH溶液的体积(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
滴定中误差较大的是第_____次实验,造成这种误差的可能原因是_______________。
A.滴定管在装标准NaOH溶液前未润洗
B.滴定开始前装标准NaOH溶液滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
C.滴定开始前装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.在装未知浓度盐酸前锥形瓶里面有少量水,未烘干
E.达到滴定终点时,俯视溶液凹液面最低点读数
F.滴定过程中,锥形瓶摇荡得太剧烈,以至有些液滴飞溅出来
G.滴定到终点时,溶液颜色由无色变到了红色
(3)该同学所测得盐酸溶液的物质的量浓度为___________(结果保留三位小数)。
查看答案和解析>>
科目:高中化学 来源:2011-2012年度上海市吴淞中学高二第一学期期末考试化学试卷 题型:实验题
(一)在配制物体的量浓度溶液时,下列操作出现的后果是(填: “偏低”、“偏高”、“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体 。
(2)配制氯化钠溶液时,容量瓶中有少量水。 。
(3)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线。 。
(二)实验室常用标准NaOH溶液测定未知盐酸溶液的浓度。
(1)配制0.5mol·L-1NaOH溶液250mL所需的玻璃仪器为 。
(2)用滴定管准确量取20.00毫升未知浓度盐酸于锥形瓶中,加入酚酞作指示剂,用NaOH溶液滴定到终点。
某学生进行了三次实验,实验数据如下表:
| 实验编号 | 盐酸体积( mL ) | 标准NaOH溶液的体积(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
查看答案和解析>>
科目:高中化学 来源:2011-2012年度上海市高二第一学期期末考试化学试卷 题型:实验题
(一)在配制物体的量浓度溶液时,下列操作出现的后果是(填: “偏低”、“偏高”、“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体。 。
(2)配制氯化钠溶液时,容量瓶中有少量水。 。
(3)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度线。 。
(二)实验室常用标准NaOH溶液测定未知盐酸溶液的浓度。
(1)配制0.5mol·L-1NaOH溶液250mL所需的玻璃仪器为 。
(2)用滴定管准确量取20.00毫升未知浓度盐酸于锥形瓶中, 加入酚酞作指示剂, 用NaOH溶液滴定到终点。
某学生进行了三次实验,实验数据如下表:
|
实验编号 |
盐酸体积( mL ) |
标准NaOH溶液的体积(mL) |
|
1 |
20.00 |
18.20 |
|
2 |
17.10 |
|
|
3 |
16.90 |
滴定中误差较大的是第_____次实验,造成这种误差的可能原因是_______________。
A.滴定管在装标准NaOH溶液前未润洗
B.滴定开始前装标准NaOH溶液滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
C.滴定开始前装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.在装未知浓度盐酸前锥形瓶里面有少量水,未烘干
E.达到滴定终点时,俯视溶液凹液面最低点读数
F.滴定过程中,锥形瓶摇荡得太剧烈,以至有些液滴飞溅出来
G.滴定到终点时,溶液颜色由无色变到了红色
(3) 该同学所测得盐酸溶液的物质的量浓度为___________(结果保留三位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com