
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 若单位时间内生成xmolNO的同时消耗xmolNH3,则反应达到平衡状态
B. 化学反应速率关系是:2v正(NH3)=3v正(H2O)
C. 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D. 达到化学平衡时,4v正(O2)=5v逆(NO)
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】(1)用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。
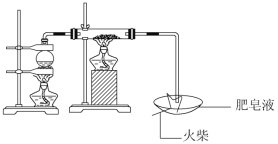
反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当肥皂泡爆破,并有爆鸣声时,说明“铁与水蒸气”能够进行反应,写出铁与水蒸气反应的化学方程式__________________________。
(2)为了研究(1)中一定时间内铁粉的消耗量,他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积(已折算成标准状况)。
①收集并测量气体体积应选下图中的________装置。
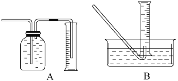
②称取0.24 g铁粉与适量石棉绒混合,然后加热至无气体放出。最好选用__________规格的量筒(选填字母序号)。
A.100 mL B.200 mL C.500 mL D.1 000 mL
(3)现有NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量)。
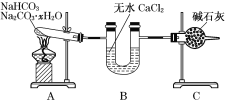
①若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7 g,用酒精灯加热到反应完全,此时B管增重1.89 g,C管增重0.22 g,则x的值为______。
②该装置还不是很完善,可能使测定结果偏小,应如何改进_____________________________。原因是___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下平衡:2SO2(g)+O2(g)2SO3(g) △H= QkJ/mol(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述平衡的影响,下列分析正确的是

A. 图I研究的是t0时刻增大O2的浓度对平衡的影响
B. 图II研究的是t0时刻加入催化剂后对反应速率和平衡的影响
C. 图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图III研究的是温度对化学平衡的影响,且乙的温度较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。 合成塔中发生反应为: N2(g)+3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。
该温度下此反应的平衡常数K =__________________________。
②保持温度不变,向上述平衡体系中再加入0.1mol CO,当反应重新建立平衡时,水蒸气的总转化率α (H2O)__________。
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1_____573K(填“>”、“<”或“=”)。
T/K | T1 | 573 | T2 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
(3)673K,30MPa下n(NH3) 和n(H2) 随时间变化的关系如下图所示依据上图,下列有关叙述正确的是(填写序号)_________________。

A.c点表示n(NH3)和n (H2)相等
B.c点表示NH3生成速率与NH3分解速率相同
C.e点和d点时反应的平衡常数相同
D.c点时正反应速率大于逆反应速率
(4)用NO2溶于水制硝酸:3NO2+H2O![]() 2HNO3+NO。从生产流程看,吸收塔中需
2HNO3+NO。从生产流程看,吸收塔中需
要补充空气,其原因用化学平衡移动的理论进行解释是______________。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索
利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中短周期的一部分。已知A元素原子的最外层电子数比其电子层数的3倍还多。下列关于表中六种元素的说法正确的是 ( )
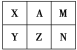
A. X的单质在空气中可以燃烧
B. X、Y、Z三种元素中Y元素形成的单核阴离子半径最大
C. 最高价氧化物对应的水化物酸性最强的是A元素
D. A单质通入NaZ溶液中,根据反应现象可证明A、Z非金属性的相对强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气可以作食品包装、灯泡等的填充气,也是合成纤维、合成橡胶的重要原料。实验室制备氮气的反应式:NH4Cl+NaNO2![]() NaCl+N2↑+2H2O。下列说法正确的是( )
NaCl+N2↑+2H2O。下列说法正确的是( )
A.元素的电负性:N>O>H
B.氮气分子的电子式:![]()
C.钠电离最外层一个电子所需要的能量:①>② ![]()
D.水中的氢键可以表示为:O—H…O,其中H…O之间的距离即为该氢键的键长
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室中浓硫酸试剂瓶标签上的部分内容,请回答问题。
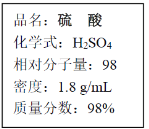
(1)该硫酸的物质的量浓度是________mol/L。
(2)某实验需要90mL3.0mol/L稀硫酸,配制该溶液,经计算,需要用量筒量取___mL浓硫酸。
(3)在下列配制过程示意图中,有错误的是(填写序号)________。

(4)下列情况会引起所配稀硫酸浓度偏高的是________。
A 用蒸馏水将量筒中残留的硫酸洗出合并 B 容量瓶洗涤后,未经干燥处理
C 溶液未能冷却就定容 D 未洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化钡广泛用于玻璃、陶瓷工业,是制取过氧化钡和钡盐的原料。一种利用钡泥[含BaCO3、BaSO3、Ba(FeO2)2等]制取氧化钡的绿色工艺流程如下:
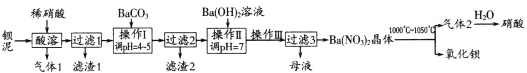
回答下列问题:
(1)酸溶时,Ba(FeO2)2与稀硝酸反应的化学方程式为_____________________。
(2)产生滤渣1的反应离子方程式是____________________________________________。
(3)操作Ⅰ调pH=4~5的目的是_________________________________________________。
(4)过滤3所得母液应返回______________工序循环使用。
(5)Ba(NO3)2可用于汽车尾气中还原性气体的催化转化。科技工作者用H2模拟尾气中的还原性气体,研究Ba(NO3)2的催化还原过程。该过程分两步进行,如图表示该过程相关物质浓度随时间的变化关系。第二步反应消耗的NH3与NO3-的物质的量之比是_________。
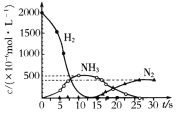
(6)“气体2”为混合气体。标准状况下a L“气体2”溶于水得到bL溶液,则所得溶液的物质的量浓度为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
A. 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B. 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
C. NaCN中通入少量CO2发生的化学反应为:NaCN+CO2+H2O=HCN+NaHCO3
D. 稀释HCN溶液过程中,![]() 减小
减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com