
【题目】磷和砷的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)黑磷是新型材料,具有类似石墨一样的片层结构(如图),层与层之间以_____结合。从结构上可以看出单层磷烯并非平面结构,但其导电性却优于石墨烯的原因是________________。
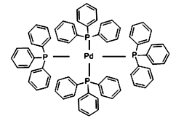
(2)四(三苯基膦)钯分子结构如下图:
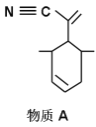
该物质可用于上图所示物质A的合成:物质A中碳原子杂化轨道类型为__________;
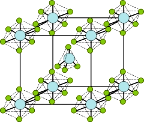
(3)PCl5是一种白色晶体,熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子.(该晶体的晶胞如图所示).熔体中P-Cl的键长只有198 nm和206 nm两种,写这两种离子的化学式为______________________;正四面体形阳离子中键角_____ PCl3的键角(填> 或<或=),原因是______________________________________.
(4)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因___________________________。
【答案】范德华力 石墨烯中1个碳原子和周围3个碳原子结合后还剩1个价电子 ,单层磷烯同层磷原子中1个磷原子和周围3个磷原子结合后还剩2个价电子 sp、sp2、sp3 PCl4+和PCl6- > PCl3中P原子有一对孤电子对,PCl4+中P没有,孤电子对对成键电子的排斥力大于成键电子对间的排斥力 PBr5=PBr4++Br-
【解析】
(1)黑磷具有类似石墨一样的片层结构,石墨层间是范德华力连接,从结构上看,单层磷烯导电性优于石墨烯,从成键原子的电子结构分析;
(2)根据碳原子的成键情况要以判断碳原子的杂化方式,物质A中甲基上的C采取sp3杂化类型,C≡N为SP杂化,碳碳双键为sp2杂化;
(3)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PCl6-,即发生反应为:2PCl5=PCl4++PCl6-;PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,正四面体形阳离子中键角小于PCl3的键角;
(4)PBr5气态分子的结构与PCl5相似,说明PBr5也能电离出能导电的阴阳离子,结合产物中只存在一种P-Br键长书写.
(1)黑磷具有类似石墨一样的片层结构,石墨层间是范德华力连接,
从结构上看,单层磷烯导电性优于石墨烯,从成键原子的电子结构分析,石墨烯同层碳原子中,1个碳原子和周围3个碳原子结合后,还剩1个价电子,单层磷烯同层磷原子中,1个磷原子和周围3个磷原子结合后,还剩2个价电子,后者剩余电子多,导电性增强。
(2)物质A中甲基上的C采取sp3杂化类型,C≡N为SP杂化,碳碳双键为sp2杂化;
(3)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PCl6-,即发生反应为:2PCl5=PCl4++PCl6-,PCl3中价层电子对个数=σ键个数+孤电子对个数=3+(5-3×1)/2=4,所以原子杂化方式是sp3,PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对.孤电子对对成键电子的排斥力大于成键电子对间的排斥力,所以PCl5中正四面体形阳离子(PCl4+)中键角大于PCl3的键角。
(4)PBr5气态分子的结构与PCl5相似,说明PBr5也能电离出能导电的阴、阳离子,而产物中只存在一种P-Br键长,所以发生这样电离PBr5═PBr4++Br-。


科目:高中化学 来源: 题型:
【题目】某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如下图所示。下列说法中,错误的是
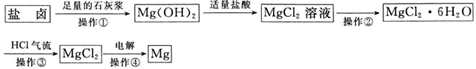
A.操作①发生的反应为非氧化还原反应
B.在实验室进行操作①时,只需要漏斗和烧杯两种玻璃仪器
C.操作②是蒸发浓缩、冷却结晶
D.在整个制备过程中未发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
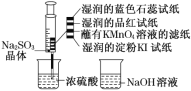
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、蘸有KMnO4溶液的滤纸均褪色都能证明SO2的漂白性
C.湿润的淀粉KI试纸未变蓝说明SO2的氧化性弱于I2
D.NaOH溶液可用于除去实验中多余的SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li2O是离子晶体,从如图的BornHaber循环可得出Li2O晶格能为 ( )
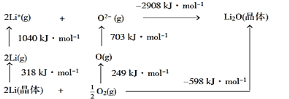
A. 598kJ·mol1B. -598KJ·mol1C. 1168kJ·mol1D. 2908kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸苯甲酯是一种难溶于水,密度大于水的无色油状液体,具有茉莉花气味,可用做调香剂。
(一)以乙烯,甲苯为原料,合成乙苯甲酯的路线如图所示。

(1)写出由乙烯制备A的化学方程式______。
(2)写出生成乙酸苯甲酯的化学方程式______。
(3)C到苯甲醇的反应类型______。
(二)制备乙酸苯甲酯的流程如图:
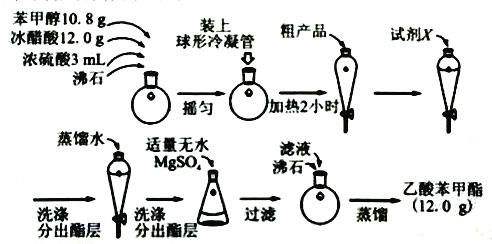
(4)球形冷凝管的作用为______。
(5)试剂X可为______。
A.氢氧化钠溶液 B.碳酸钠溶液 C.乙醇 D.氯化钠溶液
(6)分出酯层时应收集______层液体(填“上”或“下”)
(7)无水MgSO4的作用为______。
(8)本实验所得乙酸苯甲酯的产率为______。(已知:相对分子量:苯甲醇:108;乙酸:60;乙酸苯甲酯:150)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(FeSO4·7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:烧渣![]()
![]() 溶液
溶液![]() 绿矾
绿矾![]() 铁黄。已知:FeS2和铁黄均难溶于水。下列说法不正确的是( )
铁黄。已知:FeS2和铁黄均难溶于水。下列说法不正确的是( )
A.步骤①,最好用硫酸来溶解烧渣
B.步骤②,涉及的离子反应为FeS2+14Fe3++8H2O═15Fe2++2SO42+16H+
C.步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D.步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机反应中,加氧或去氢的反应称之为氧化反应,反之则称为还原反应,下列反应中属于还原反应的是
A.CH3CHO ![]() CH3CH3OHB.CH3COOH
CH3CH3OHB.CH3COOH ![]() CH3COOC2H5
CH3COOC2H5
C.![]()
![]()
![]() D.
D.![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。下列判断正确的是( )
A.升高温度,该反应的平衡常数减小
B.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
C.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D.第二阶段,Ni(CO)4分解率较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为元素周期表中的一部分,表中列出10种元素在周期表中的位置,按要求回答下列各题![]() 请用对应的元素符号作答,填序号无效
请用对应的元素符号作答,填序号无效![]()
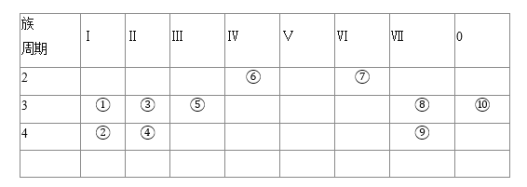
(1)化学性质最不活泼的元素符号是______,金属性最强的单质与水反应的化学方程式是______.
(2)①③⑤三种元素最高价氧化物的水化物中碱性最强的物质的化学式是______.
(3)元素①形成的稳定的氧化物在呼吸面具中供氧时的化学方程式是______,该化合物的焰色反应为______色.
(4)②③⑤三种元素形成的离子,离子半径由大到小的顺序是______.
(5)元素⑧的单质和石灰乳作用可制成有漂白和消毒作用的漂白粉,用化学方程式表示漂白粉在潮湿空气中起漂白作用的原理______.
(6)如何证明⑧和⑨元素的非金属性强弱______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com