
����Ŀ����ʵ������������230mL 0.1mol/L��Na2CO3��Һ����ղ���ش��������⣺
��1��ʵ����������ƽ��Na2CO3����______________��
��2��Ӧѡ������ƿ�Ĺ��Ϊ��_________��������ƿ���Ҫ������������______��
��3������ʱ������ȷ�IJ���˳���ǣ���ĸ��ʾ��ÿ����ĸֻ����һ�Σ�___________��
A����30mLˮϴ���ձ�2~3�Σ�ϴ��Һ��ע������ƿ����
B����������ƽȷ����ȡ�����Na2CO3�������������ձ��У��ټ�������ˮ��Լ30mL�����ò���������������ʹ����ȫ�ܽ�
C��������ȴ��Na2CO3��Һ�ز�����ע��һ����������ƿ��
D��������ƿ�ǽ�����ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ����ǡ����̶�����
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1~2cm��
��4�������������������������ҺŨ�Ƚ��к�Ӱ�죨����ƫ��������ƫ����������Ӱ������
����û�н���A����_______________��
����������ˮʱ���������˿̶�_______________��
��ʵ����������250 mL 0.1 mol��L�Ĵ��ᣨCH3COOH��������36%�Ĵ��ᣬ�ܶ�Ϊ1.04g��mL����Ҫ��ش��������⣺
��1����Ҫ��Ͳȡ��36%�Ĵ���________ mL�������ƣ�
��2��������ʱ��������һ����������ͼ��ʾ���д�����������ȫ����ȷ������������Ũ��___________��������ȷ������ƫ��������ƫ��������
���𰸡�2.7g 250mL ������ƽ���ձ�������������ͷ�ι� B��C��A��F��E��D ƫ�� ƫ�� 4.0 ƫ��
��������
��������230mL 0.1mol/L��Na2CO3��Һ��Ӧѡ��250mL������ƿ��ʵ�鲽�裬���㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȣ�
��������c=![]() ����Ũ�����Ũ�ȣ�����c1��V1=c2��V2���������
����Ũ�����Ũ�ȣ�����c1��V1=c2��V2���������
������1������230mL 0.1mol/L��Na2CO3��Һ��Ӧѡ��250mL������ƿ������250mL����Һ�������Na2CO3����=c��V��M=0.1mol/L��0.25L��106g/mol=2.65g����Ҫ����2.7g��
��2��Ӧѡ������ƿ�Ĺ��Ϊ250mL������ʵ�鲽�裬���㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȣ�ʹ�õ�������:��ƽ����Ͳ���ɲ�ѡ�����ձ�����������250mL������ƿ����ͷ�ιܣ���Ϊ������ƽ���ձ�������������ͷ�ιܣ�
��3������ʱ������ʵ�鲽�裬���㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȣ������˳��ΪB��C��A��F��E��D��
��4������û�н���ϴ�Ӳ���������������Һ�����ʵ����ʵ���ƫС����Ũ��ƫ�ͣ�
����������ˮʱ���������˿̶ȣ�������Һ�����ƫ��Ũ��ƫ�ͣ�
������1��36%�Ĵ����Ũ��=![]() =
=![]() =6.24mol/L��V��CH3COOH��=
=6.24mol/L��V��CH3COOH��=![]() mL=4.0mL��
mL=4.0mL��
��2������ͼ���֪������ʱ���ӣ�����������Һ�����ƫ������ҺŨ��ƫ�͡�


 ��������������������ϵ�д�
��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ԭ�ӵ�������a g��12Cԭ�ӵ�������b g����NA��ʾ�����ӵ�������ֵ������˵������ȷ����(����)
�ٸ���ԭ�ӵ����ԭ������Ϊ12a/b
��m g����ԭ�ӵ����ʵ���Ϊm/(aNA) mol
�۸���ԭ�ӵ�Ħ��������aNA g
��a g����ԭ�������ĵ�����Ϊ8 mol
A. �٢�B. �ڢ�C. �٢�D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�ˮ����ȡ�������·�Ӧ��5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O����÷�Ӧ��������ԭ��Ӧԭ���������Ƶ���
A.2NaBr+Cl2=2CaCl+Br2
B.AlCl3+3NaAlO2+6H2O=4Al(OH)3��+3NaCl
C.2H2S+SO2=2H2O+3S��
D.2KMnO4![]() K2MnO4��MnO2��O2��
K2MnO4��MnO2��O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������OH-�����·���ˮ�ⷴӦ��O2NC6H4COOC2H5+OH-O2NC6H4COOO-+C2H5OH���ַ�Ӧ��ij�ʼŨ�Ⱦ�Ϊ0.050mol/L���ڲ�ͬ�¶��²��O2NC6H4COOC2H5��Ũ�ȣ�mol/L����ʱ��仯���������±���ʾ�������й�˵������ȷ���ǣ�������
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
15�� | 0.500 | 0.335 | 0.291 | 0.256 | 0.210 | 0.155 | 0.148 | 0.145 | 0.145 |
35�� | 0.500 | 0.325 | 0.2775 | 0.238 | 0.190 | �� | 0.135 | 0.135 | 0.135 |
A. �÷�Ӧ��![]() ��120180s������O2NC6H4COOC2H5ƽ����Ӧ����Ϊ7.33��10 -4 mol��L-1��s-1
��120180s������O2NC6H4COOC2H5ƽ����Ӧ����Ϊ7.33��10 -4 mol��L-1��s-1
B. �����ݿ�֪�����ŷ�Ӧ�Ľ��У���Ӧ���Ũ�Ƚ��ͣ���Ӧ���ʼ���
C. 530sʱ��������35���Ӧ������һ����0.135
D. �����ݿ�֪���¶����߷�Ӧ���ʼӿ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�ij�����м���������̼��Ʒ�����Ӧ��CaCO3(s)CaO(s)+CO2(g) ��H��0��һ��ʱ���ﵽƽ�⡣
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=______�� Ϊ�����CO2�������ʣ��ɲ�ȡ�Ĵ�ʩ______
A����ѹB������C������̼��Ƶ���D��ת�Ƴ�CO2
��2�����ڸ÷�Ӧ������˵����ȷ����______
A��CaCO3(s)���ȷֽ�����CaO(s)��CO2(g)����S��0
B����������СΪԭ����һ�룬ƽ�ⲻ�ƶ�
C������������Ϊԭ����������ƽ�ⷢ���ƶ����ٴ�ƽ��������ܶȲ���
D������ѹǿ��ƽ�������ƶ���Kֵ��С
���ں��º�ѹ�ܱ�������ͨ��CO��H2O��1mol������ӦCO(g)+H2O(g)CO2(g)+H2(g)������Ӧ�ﵽƽ���ά���¶���ѹǿ���䣬t1 ʱ��ͨ���1 mol��CO ��H2O �Ļ�����壬������ͼ�л�������Ӧ���淴Ӧ������t1����ʱ��t�仯������ͼ��
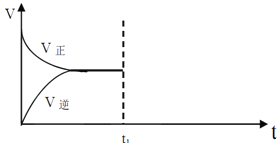 ____________
____________
����������ɳɷָ��ӣ����������ִ�����ѧ�����������塣ͼ���װ�ÿɽ������е�SO2��NOת��Ϊ(NH4)2SO4�������ĵ缫��Ӧʽ��______������A��______�������ƣ�
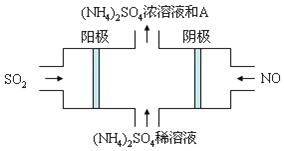
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ժ�﮵��������(��Ҫ�� AlF3�� NaF��LiF��CaO ) ��Ũ����Ϊԭ�ϣ��Ʊ���ؼ�̼��ﮣ�ͬʱ�ø���Ʒ����ʯ���乤���������£�

��֪LiOH������ˮ��Li2CO3����ˮ���ش��������⣺
(1)�����������Ũ���ᷴӦ���������廯ѧʽΪ ___________������2����Ҫ�ɷ���(д��ѧʽ)_________��
(2)��ⷴӦ�У� ͬʱ�õ�����ͳ�����Ӧ�����ӷ���ʽΪ_____________��
(3)һ���˵ K��105 ʱ���÷�Ӧ���еþͻ�����ȫ�ˡ�������Ӧ�д�������ƽ�⣺Li2CO3(s)+Ca2+(aq)2Li+(aq)+ CaCO3(s)ͨ������˵���÷�Ӧ�Ƿ������ȫ________(��֪Ksp(Li2CO3) = 8.64��10-4��Ksp(CaCO3) = 2.5��10-9)��
(4)̼����Ӧ�����Һ�õ�Li2CO3�ľ���ʵ������У�����Ũ����______��______�����
(5)�������̵õ�����Ʒ����ʯ�Ļ�ѧ����ʽΪ__________��
(6)Li2CO3���Ʊ�����﮵���Ҫԭ�ϣ� һ���Ʊ�����﮵��·�����ù��ҷ���ר������װ����ͼ��ʾ��

����ʱ�缫 C Ӧ���ӵ�Դ��______���������ĵ缫��ӦʽΪ__________ ���÷�����Ƶ� A ���ܱ�������̼��﮶��豸�ĸ�ʴ����________�ݳ��Ի�������Ⱦ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ����д�����ۣ�����������
ѡ�� | ���ӷ���ʽ | ���� |
A | ��ͭ�缫��ⱥ��KCl��Һ��2H2O+2Cl- | ��ȷ��Cl-��ʧ����������OH-ǿ |
B | ��CuSO4��Һ��ͨ�������H2S���壺Cu2++H2S=CuS��+2H+ | ����H2S�����Ա�H2SO4�� |
C | Ba(HCO3)2��Һ��������NaOH��Һ��Ӧ��Ba2++HCO3- +OH- �TBaCO3��+H2O | ����Ba2+��HCO3-ϵ����ӦΪ1:2 |
D | ����SO2ͨ�뵽NaClO��Һ�У�SO2+ClO- +H2O= HClO+HSO3- | ��ȷ��H2SO3�����Ա�HClOǿ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�����ܷdz���Խ�Ľ�����21���ͽ����ѵ����͡�
(1)TiO2��Ĥ�в��Ӹ���������߹�����ԡ���̬Crԭ�ӵĺ�������Ų�ʽΪ____��
(2)���Ҵ������������ڽ��������ճ���ԡ����Ʊ�ԭ�����£�TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl
��Ti(OCH2CH3)4�������л��ܼ���������Ϊ����ɫ��Һ�壬�侧������Ϊ____
��N��Oλ��ͬһ���ڣ�O�ĵڶ������ܴ���N�ĵڶ������ܵ�ԭ����_____��
��NH4Cl�д��ڵ���������_____��NH4Cl�۷е����CH3CH2OH��ԭ����_____��Ti(OCH2CH3)4������Cԭ�ӵ��ӻ���ʽ��Ϊ ____��
(3)������(SrTiO3)���������մɲ��Ϻ����챦ʯ������һ�־����ṹ��ͼ��ʾ����Tiλ�ڶ���λ�ã�Oλ��____λ�ã���֪��������Ϊa nm��Tiλ��O���γɵ�������������ģ���ð�����ı߳�Ϊ_____ m(�г�����ʽ)��
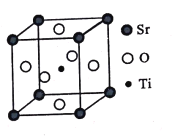
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ�������ö������̸�Ũ���ᷴӦ�Ʊ����﴿�������������д�ʵ�飬����������ͼ��ʾ��
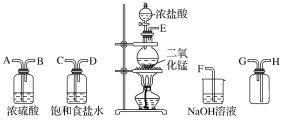
��1������������������ȷ˳��(����ӿڴ�����ĸ)��__��__��__��__��__��___��__��__��
��2��װ���У�����ʳ��ˮ��������___��NaOH��Һ��������___��
��3����ѧʵ���г���ʪ���KI��������ֽ�����Ƿ���Cl2�����������Cl2�������ɹ۲쵽___����Ӧ�Ļ�ѧ����ʽΪ___��
��4��д�����з�Ӧ�Ļ�ѧ����ʽ��
�����巢��װ���н��еķ�Ӧ��___��
��NaOH��Һ�з����ķ�Ӧ��___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com