
【题目】钛是一种性能非常优越的金属,21世纪将是钛的世纪。
(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Cr原子的核外电子排布式为____。
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为____
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是_____;
③NH4Cl中存在的作用力有_____,NH4Cl熔沸点高于CH3CH2OH的原因是_____,Ti(OCH2CH3)4分子中C原子的杂化形式均为 ____。
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于____位置;已知晶胞参数为a nm,Ti位于O所形成的正八面体的体心,则该八面体的边长为_____ m(列出表达式)。
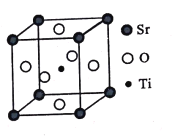
【答案】1s22s22p63s23p63d54s1 分子晶体 O和N分别失去一个电子后的价电子排布式1s22s22p3和1s22s22p2,前者是半充满结构,比后者稳定,所以第二电离能,前者大于后者 配位键、离子键、共价键 前者为离子晶体,后者为分子晶体(或离子键强于分子间作用力),离子晶体的熔沸点高于分子晶体的熔沸点 sp3杂化 棱心 ![]() a×10-9
a×10-9
【解析】
(1)根据核外电子的排布规则写出铬的核外电子排布式,注意3d轨道为半充满状态;
(2)①可溶于有机溶剂,根据相似相容原理,判断晶体的类型;
②写出N和O价电子排布式,然后分析;
③从氯化铵的电子式,判断化学键的类型;从晶体的类型不同判断熔沸点差异的原因;Ti(OCH2CH3)4分子中C原子的成键数目判断杂化方式;
(3)从晶胞的内部结构,根据Ti的位置,判断氧的位置;根据Ti和O的距离,计算八面体的边长。
(1)Cr原子是24号元素,核外电子排布式为1s22s22p63s23p63d54s1;
(2) ① Ti(OCH2CH3)4可溶于有机溶剂,有机溶剂大多数都是分子晶体,根据相似相溶,Ti(OCH2CH3)4是分子晶体;
②O和N分别失去一个电子后的价电子排布式2s22p3和2s22p2,前者是半充满结构,比后者稳定,所以第二电离能,前者大于后者;
③根据氯化铵的电子式: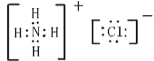 ,可以看出氯化铵中的化学键有铵根离子和氯离子间的离子键,氮原子和氢原子间共价键,氮原子与三个氢原子形成三对共价键,剩余一对电子与氢原子形成一对配位键,所以氯化铵中存在的作用力有离子键,共价键,配位键;
,可以看出氯化铵中的化学键有铵根离子和氯离子间的离子键,氮原子和氢原子间共价键,氮原子与三个氢原子形成三对共价键,剩余一对电子与氢原子形成一对配位键,所以氯化铵中存在的作用力有离子键,共价键,配位键;
Ti(OCH2CH3)4分子中C均形成四对σ键,故杂化方式为sp3杂化;
(3)从图中可以看出,若Ti位于顶点位置,则O可以看成位于棱心的中心位置;
Ti位于O所形成的正八面体的体心,八面体中Ti和O构成了一个等腰直角三角形,直角边长为![]() a,斜边长为
a,斜边长为![]() =
=![]() anm=
anm=![]() a×10-9m。
a×10-9m。


科目:高中化学 来源: 题型:
【题目】实验室需要0.1 molL1NaOH溶液500mL和0.5 molL1硫酸溶液480mL。根据这两种溶液的配制情况回答下列问题:
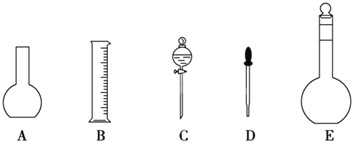
(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器有玻璃棒和______(填仪器名称)。
(2)容量瓶使用前必须进行的一步操作是___________。
(3)根据计算,该实验用托盘天平称取NaOH的质量为______g。在实验中其他操作均正确,若称量NaOH溶液时砝码生锈,则所得溶液浓度______0.1molL1(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度______0.1molL1。
(4)在配制稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)?
①未经冷却趁热将溶液注入容量瓶中:___________。
②定容时仰视观察液面:___________。
③用量筒量取浓硫酸时俯视:______________。
(5)在实验过程中出现如下情况应如何处理?
加蒸馏水时不慎超过了刻度,应_________;加蒸馏水到刻度下1cm ~ 2 cm处应__________滴加至凹液面最低处与刻度线相切;移液时不慎将少量液滴滴在容量瓶外面,应_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室用需配制230mL 0.1mol/L的Na2CO3溶液,填空并请回答下列问题:
(1)实际用托盘天平称Na2CO3质量______________;
(2)应选用容量瓶的规格为:_________,除容量瓶外还需要的其它仪器:______;
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___________;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确称量取所需的Na2CO3的质量,放入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其完全溶解
C.将已冷却的Na2CO3溶液沿玻璃棒注入一定规格的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)
①若没有进行A操作_______________;
②若加蒸馏水时不慎超过了刻度_______________。
Ⅱ.实验室需配制250 mL 0.1 mol/L的醋酸(CH3COOH),现有36%的醋酸,密度为1.04g/mL,按要求回答下列问题:
(1)需要量筒取用36%的醋酸________ mL进行配制;
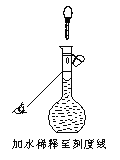
(2)若配制时仅有其中一步操作(如图所示)有错误,其他操作全部正确,则所配醋酸的浓度___________(填“正确”、“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现氯离子(Cl-)、硫酸根离子(SO42-)和硝酸根离子(NO3-)的相互分离,实验过程如下:
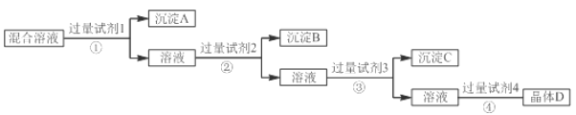
试剂3:Na2CO3;试剂4:硝酸
请回答下列问题:
(1)写出试剂②的名称______________。
(2)写出过量Na2CO3的目的是___________________________________________________。
(3)写出混合溶液D与过量硝酸反应的化学方程式:________________________________。
(4)写出操作④的名称______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 AgNO3 溶液分别滴定浓度均为 0.01 mol/L 的KCl、K2C2O4 溶液,所得的沉淀溶解平衡图像如图所示(不考虑 C2O42-的水解)。已知 Ksp(AgCl) 数量级为 10-10。下列叙述正确的是
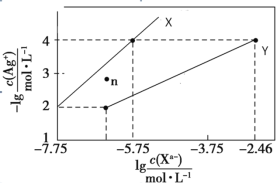
A.图中 Y 线代表的 AgCl
B.n 点表示 Ag2C2O4 的过饱和溶液
C.向 c(Cl-)=c(C2O42-)的混合液中滴入 AgNO3溶液时,先生成 AgCl 沉淀
D.Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数为 10-0.71
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应与酸性氧化物的通性无关的是( )
A. 存放NaOH的试剂瓶不用磨口玻璃塞B. ![]() 与水反应制备氧气
与水反应制备氧气
C. 烧煤时加入生石灰脱硫D. ![]() 与澄清石灰水作用
与澄清石灰水作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一块表面已被氧化成氧化钠的钠块(质量为5.4 g)投入足量的水中,产生标准状态下的H2 1.12 L,则原来被氧化的钠的质量为
A.5.3gB.4.6 gC.3.1 gD.2.3 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于钠及其化合物性质的叙述,正确的是( )
A.钠的化学性质活泼,可以和![]() 溶液反应制取金属钛
溶液反应制取金属钛
B.氧化钠和过氧化钠都能与二氧化碳反应,生成物完全相同
C.过氧化钠是淡黄色固体,可用于呼吸面具中作为氧气的来源
D.![]() 与酸反应的剧烈程度强于
与酸反应的剧烈程度强于![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com