
【题目】常温下,用 AgNO3 溶液分别滴定浓度均为 0.01 mol/L 的KCl、K2C2O4 溶液,所得的沉淀溶解平衡图像如图所示(不考虑 C2O42-的水解)。已知 Ksp(AgCl) 数量级为 10-10。下列叙述正确的是
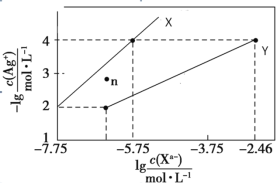
A.图中 Y 线代表的 AgCl
B.n 点表示 Ag2C2O4 的过饱和溶液
C.向 c(Cl-)=c(C2O42-)的混合液中滴入 AgNO3溶液时,先生成 AgCl 沉淀
D.Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数为 10-0.71
【答案】C
【解析】
若曲线X为AgCl的沉淀溶解平衡曲线,则Ksp(AgCl)=c(Ag+)c(Cl)=104×105.75=109.75=100.25×1010,则数量级为10-10,若曲线Y为AgCl的沉淀溶解平衡曲线,则Ksp(AgCl)=c(Ag+)c(Cl)=104×102.46=106.46=100.54×107,则数量级为10-7,又已知Ksp(AgCl)数量级为 10-10,则曲线X为AgCl的沉淀溶解平衡曲线,则曲线Y为Ag2C2O4的沉淀溶解平衡曲线,Ksp(Ag2C2O4)=c2(Ag+)c(C2O42-)=(104)2×(102.46)=1010.46,据此分析解答。
若曲线X为AgCl的沉淀溶解平衡曲线,则Ksp(AgCl)=c(Ag+)c(Cl)=104×105.75=109.75=100.25×1010,则数量级为10-10,若曲线Y为AgCl的沉淀溶解平衡曲线,则Ksp(AgCl)=c(Ag+)c(Cl)=104×102.46=106.46=100.54×107,则数量级为10-7,又已知Ksp(AgCl)数量级为 10-10,则曲线X为AgCl的沉淀溶解平衡曲线,则曲线Y为Ag2C2O4的沉淀溶解平衡曲线,Ksp(Ag2C2O4)=c2(Ag+)c(C2O42-)=(104)2×(102.46)=1010.46,
A. 由以上分析知,图中X线代表AgCl,故A错误;
B. 曲线Y为Ag2C2O4的沉淀溶解平衡曲线,在n点,c(Ag+)小于平衡浓度,故n点的离子Qc(Ag2C2O4)<Ksp(Ag2C2O4),故为Ag2C2O4的不饱和溶液,故B错误;
C. 根据图象可知,当阴离子浓度相同时,生成AgCl沉淀所需的c(Ag+)小于生成Ag2C2O4沉淀所需的c(Ag+),故向c(Cl)=c(C2O42-)的混合液中滴入AgNO3溶液时,先析出氯化银沉淀,故C正确;
D. Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数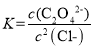 ,此时溶液中的c(Ag+)相同,故有
,此时溶液中的c(Ag+)相同,故有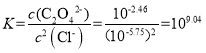 ,故D错误;
,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】2019年12月以来,我国武汉等地相继暴发了新冠肺炎,为此我国政府和相关部门采取了多项措施控制疫情。75%乙醇和84消毒液等均能有效灭活新冠病毒。84消毒液的主要成分是次氯酸钠。设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.74.5g次氯酸钠中含有的离子数目为2NA
B.1mol次氯酸钠与足量盐酸反应转移的电子数为2NA
C.46g75%乙醇中含有的氧原子数大于6NA
D.利用氯气和氢氧化钠溶液反应制取0.1mol次氯酸钠需要消耗2.24L氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、一定温度下,某容器中加入足量的碳酸钙发生反应:CaCO3(s)CaO(s)+CO2(g) △H>0;一段时间后达到平衡。
(1)该反应的化学平衡常数表达式为K=______; 为了提高CO2的生成率,可采取的措施______
A.减压B.升温C.增加碳酸钙的量D.转移出CO2
(2)对于该反应,下列说法正确的是______
A.CaCO3(s)加热分解生成CaO(s)和CO2(g),△S>0
B.将容器缩小为原来的一半,平衡不移动
C.将容器扩大为原来的两倍,平衡发生移动,再次平衡后,气体密度不变
D.增大压强,平衡逆向移动,K值减小
Ⅱ、在恒温恒压密闭容器中通入CO和H2O各1mol发生反应CO(g)+H2O(g)CO2(g)+H2(g),当反应达到平衡后,维持温度与压强不变,t1 时再通入各1 mol的CO 和H2O 的混合气体,请在下图中画出正反应和逆反应速率在t1后随时间t变化的曲线图。
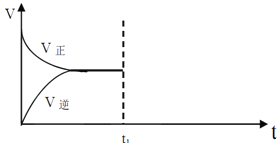 ____________
____________
Ⅲ、雾霾的组成成分复杂,包括数百种大气化学颗粒物与气体。图电解装置可将雾霾中的SO2、NO转化为(NH4)2SO4,阴极的电极反应式是______,物质A是______(填名称)
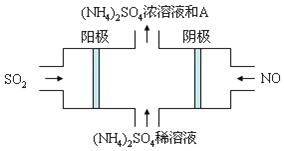
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):
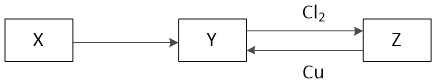
(1)若X是一种生活中使用量最大的金属单质
①写出Z与Cu反应的离子方程式:_____
②如何设计实验检验Z中阳离子:_____
(2)若X是一种非金属单质,常温下为固体,Y是一种能使品红溶液褪色且加热后又能恢复原来颜色的化合物。
①写出构成X单质的元素在元素周期表中的位置:_____
②写出Z与Cu反应的化学方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种性能非常优越的金属,21世纪将是钛的世纪。
(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Cr原子的核外电子排布式为____。
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为____
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是_____;
③NH4Cl中存在的作用力有_____,NH4Cl熔沸点高于CH3CH2OH的原因是_____,Ti(OCH2CH3)4分子中C原子的杂化形式均为 ____。
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于____位置;已知晶胞参数为a nm,Ti位于O所形成的正八面体的体心,则该八面体的边长为_____ m(列出表达式)。
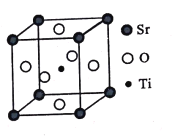
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下:
(1)0.5 mol HCl占有的体积是__________L。
(2)33.6 L H2的摩尔质量是__________。
(3)在9.5 g某二价金属的氯化物固体中含有0.2 mol Cl-,将此固体加水溶解稀释为100毫升,则此氯化物的摩尔质量为_________此氯化物溶液的物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是资源的宝库,蕴含着丰富的化学元素,如钠、镁、氯、溴等。
(1)写出电解饱和食盐水的离子方程式__________________;
(2)对水进行处理时,可加入明矾除去水中的悬浮颗粒,用离子方程式表示反应原理__________________;
(3)漂白粉可以对自来水进行杀菌消毒,写出工业上用石灰乳制漂白粉的化学方程式__________________;当![]() 氯气参与反应时,转移电子数为______。
氯气参与反应时,转移电子数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是
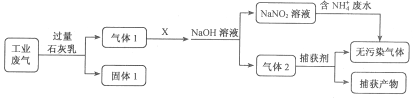
A. 固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com