
【题目】海洋是资源的宝库,蕴含着丰富的化学元素,如钠、镁、氯、溴等。
(1)写出电解饱和食盐水的离子方程式__________________;
(2)对水进行处理时,可加入明矾除去水中的悬浮颗粒,用离子方程式表示反应原理__________________;
(3)漂白粉可以对自来水进行杀菌消毒,写出工业上用石灰乳制漂白粉的化学方程式__________________;当![]() 氯气参与反应时,转移电子数为______。
氯气参与反应时,转移电子数为______。
【答案】2Cl-+2H2O![]() Cl2↑+H2↑+2OH- Al3++3H2O
Cl2↑+H2↑+2OH- Al3++3H2O ![]() Al(OH)3(胶体)+3H+ 2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O NA
Al(OH)3(胶体)+3H+ 2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O NA
【解析】
(1)在电流作用下,氯化钠和水反应生成氢氧化纳、氢气和氯气;
(2)明矾是强酸弱碱盐,电离出的铝离子在溶液中水解生成氢氧化铝胶体,胶体具有吸附性,能吸附水中的悬浮物而达到净水的目的;
(3)漂白粉的主要成分是氯化钙和次氯酸钙,氯气与石灰乳反应生成氯化钙、次氯酸钙和水。
(1)电解饱和食盐水时,在电流作用下,氯化钠和水反应生成氢氧化纳、氢气和氯气,反应的离子方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-,故答案为:22Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为:22Cl-+2H2O![]() Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
(2)明矾是强酸弱碱盐,电离出的铝离子在溶液中水解生成氢氧化铝胶体,胶体具有吸附性,能吸附水中的悬浮物而达到净水的目的,水解的离子方程式为Al3++3H2O![]() Al(OH)3+3H+,故答案为:Al3++3H2O
Al(OH)3+3H+,故答案为:Al3++3H2O ![]() Al(OH)3+3H+;
Al(OH)3+3H+;
(3)漂白粉的主要成分是氯化钙和次氯酸钙,工业上用氯气与石灰乳反应制得,氯气与石灰乳反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,1mol氯气反应时,转移1mol电子,电子数目为NA,故答案为:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O;NA。


科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下所示,其中T所处的周期序数与族序数相等,下列判断错误的是
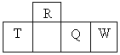
A.W和R形成的化合物属于共价化合物
B.元素R与氢形成的化合物有很多种
C.含T的盐溶液可能能与NaOH溶液反应也可能与盐酸反应
D.常温下,T的单质与W的最高价氧化物对应水化物的浓溶液反应产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 AgNO3 溶液分别滴定浓度均为 0.01 mol/L 的KCl、K2C2O4 溶液,所得的沉淀溶解平衡图像如图所示(不考虑 C2O42-的水解)。已知 Ksp(AgCl) 数量级为 10-10。下列叙述正确的是
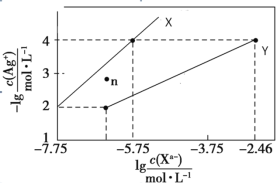
A.图中 Y 线代表的 AgCl
B.n 点表示 Ag2C2O4 的过饱和溶液
C.向 c(Cl-)=c(C2O42-)的混合液中滴入 AgNO3溶液时,先生成 AgCl 沉淀
D.Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数为 10-0.71
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应与酸性氧化物的通性无关的是( )
A. 存放NaOH的试剂瓶不用磨口玻璃塞B. ![]() 与水反应制备氧气
与水反应制备氧气
C. 烧煤时加入生石灰脱硫D. ![]() 与澄清石灰水作用
与澄清石灰水作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分。当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如右图所示位置(两侧温度相同)。则混合气体中CO和CO2的分子个数比为 ( )

A.1:1 B.1:3 C.2:1 D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一块表面已被氧化成氧化钠的钠块(质量为5.4 g)投入足量的水中,产生标准状态下的H2 1.12 L,则原来被氧化的钠的质量为
A.5.3gB.4.6 gC.3.1 gD.2.3 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(![]() )是有机合成的重要还原剂,其合成线路如下图所示。
)是有机合成的重要还原剂,其合成线路如下图所示。
![]()
(1)无水![]() (
(![]() 升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
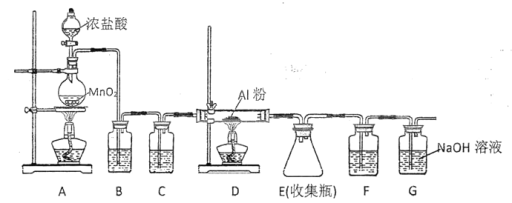
①![]() 中发生反应的化学方程式为__________________。
中发生反应的化学方程式为__________________。
②实验时应先点燃______(填“![]() ”或“
”或“![]() ”)处酒精灯,当观察到____________时,再点燃另一处酒精灯。
”)处酒精灯,当观察到____________时,再点燃另一处酒精灯。
③装置![]() 中盛放饱和NaCl溶液,该装置的主要作用是__________________,请结合方程式进行解释__________________。
中盛放饱和NaCl溶液,该装置的主要作用是__________________,请结合方程式进行解释__________________。
④![]() 中试剂的作用是__________________。用一件仪器装填适当试剂后也可起到
中试剂的作用是__________________。用一件仪器装填适当试剂后也可起到![]() 和
和![]() 的作用,所装填的试剂为__________________。
的作用,所装填的试剂为__________________。
(2)制取铝氢化钠的化学方程式是__________________。
(3)改变![]() 和
和![]() 中的试剂就可以用该装置制取NaH,NaH中氢元素化合价为______,若装置中残留有氧气,制得的NaH中可能含有的杂质为______。
中的试剂就可以用该装置制取NaH,NaH中氢元素化合价为______,若装置中残留有氧气,制得的NaH中可能含有的杂质为______。
(4)铝氢化钠遇水发生剧烈反应,其反应的化学方程式为____________。欲测定铝氢化钠粗产品(只含有NaH杂质)的纯度。称取![]() 样品与水完全反应后,测得气体在标准状况下的体积为
样品与水完全反应后,测得气体在标准状况下的体积为![]() ,样品中铝氢化钠的质量分数为______。(结果保留两位有效数字)
,样品中铝氢化钠的质量分数为______。(结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1: 45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O, 该反应的化学方程式为_________________________。
②方法2: 先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。 M'的化学式为______。
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。 为测定某碱式氯化铜的组成, 进行下列实验:
①称取样品1.1160 g,用少量稀HNO3溶解后配成100.00 mL溶液A;
②取25. 00 mL溶液A,加入足量AgNO3溶液,得AgCl 0. 1722 g;③另取25. 00 mL溶液A,调节pH 4 ~ 5,用浓度为0.08000 mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式(写出计算过程)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图所示所得出的结论正确的是
A.图甲是一定温度下,处于恒容密闭容器、弱酸性环境下的铁钉发生腐蚀过程中体系压强的变化曲线,可推知初始阶段铁钉主要发生析氢腐蚀
B.图乙是平衡体系2NO2(g)![]() N2O4(g);ΔH=-56.9 kJ·mol-1改变某一条件后v(正)、v(逆)的变化情况,可推知t0时刻改变的条件是升高温度
N2O4(g);ΔH=-56.9 kJ·mol-1改变某一条件后v(正)、v(逆)的变化情况,可推知t0时刻改变的条件是升高温度
C.图丙是某温度下c(CH3COOH)+c(CH3COO-)=0.100 mol·L-1的醋酸与醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系,可推知该温度下pH=3的溶液中:Ka<10-4.75
D.图丁中虚线是2SO2+O2![]() 2SO3在催化剂存在下反应过程中能量的变化情况,可推知催化剂Ⅰ的催化效果更好
2SO3在催化剂存在下反应过程中能量的变化情况,可推知催化剂Ⅰ的催化效果更好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com