
【题目】X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):
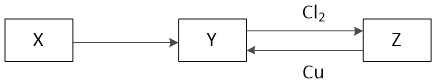
(1)若X是一种生活中使用量最大的金属单质
①写出Z与Cu反应的离子方程式:_____
②如何设计实验检验Z中阳离子:_____
(2)若X是一种非金属单质,常温下为固体,Y是一种能使品红溶液褪色且加热后又能恢复原来颜色的化合物。
①写出构成X单质的元素在元素周期表中的位置:_____
②写出Z与Cu反应的化学方程式_____
【答案】2Fe3++Cu=2Fe2++Cu2+ 取少量Z的液体,加入KSCN溶液,若溶液变血红色则含有Fe3+(或取少量Z的液体,加入NaOH溶液,若立即产生红褐色的沉淀则含有Fe3+) 第3周期第ⅥA族 Cu+2H2SO4(浓)![]() CuSO4+SO2 ↑+2H2O
CuSO4+SO2 ↑+2H2O
【解析】
X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素:
(1)若X是一种生活中使用量最大的金属单质判断为Fe,铁为变价金属元素,Y和氯气反应生成Z证明Y为亚铁盐,Z为铁盐,Z与Cu反应为铁离子氧化铜生成亚铁离子和铜离子;
(2)若X是一种非金属单质,常温下为固体;Y是一种能使品红溶液褪色且加热后又能恢复原来颜色的化合物,判断Y为SO2,则X为S,Z为H2SO4。
X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素。
(1)若 X 是一种生活中使用量最大的金属单质,则X为Fe,结合图中转化可知,Y为FeCl2,Z为FeCl3。
①Z与Cu反应的离子方程式:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
②设计实验检验Z中阳离子:取少量Z的液体,加入KSCN溶液,若溶液变血红色则含有Fe3+(或取少量Z的液体,加入NaOH溶液,若立即产生红褐色的沉淀则含有Fe3+),故答案为:取少量Z的液体,加入KSCN溶液,若溶液变血红色则含有Fe3+(或取少量Z的液体,加入NaOH溶液,若立即产生红褐色的沉淀则含有Fe3+);
(2)若 X 是一种非金属单质,常温下为固体,Y 是一种能使品红溶液褪色且加热后又能恢复原来颜色的化合物,则X为S,Y为SO2,Z为H2SO4。
①构成X单质的元素在元素周期表中的位置:第3周期第ⅥA族,故答案为:第3周期第ⅥA族;
②Z与Cu反应的化学方程式:Cu+2H2SO4(浓)![]() CuSO4+SO2 ↑+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2 ↑+2H2O,故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2 ↑+2H2O。
CuSO4+SO2 ↑+2H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A. 所得溶液的物质的量浓度为1 mol·L-1
B. 所得溶液中含有NA个HCl分子
C. 36.5 g HCl气体占有的体积为22.4 L
D. 所得溶液的质量分数:w=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,实验测得1.0mol/L NH4HCO3 溶液pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是( )
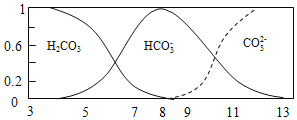
A. 常温下,Kb(NH3H2O)>Ka1(H2CO3)>Ka2(H2CO3)
B. pH=13时,溶液中不存在HCO3-的水解平衡
C. pH由8~11 时,随着pH值的增大,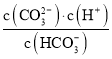 增大
增大
D. pH=3时,有c(NH4+)+c(NH3H2O)=c(HCO3-)+c(H2CO3)+c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾K3[Fe(C2O4)3]xH2O晶体是一种亮绿色的晶体,是制备负载型活性铁催化剂的主要原料,也是一种有机反应良好的催化剂。已知M(K3[Fe(C2O4)3])=437g/mol。本实验以(NH4)2Fe(SO4)26H2O(硫酸亚铁铵晶体)为原料,加入草酸(H2C2O4)制得草酸亚铁(FeC2O4)后,在过量的草酸根(C2O42-)部分实验过程如下:
![]()
(1)在沉淀A中加入饱和K2C2O4溶液,并用40℃左右水浴加热,再向其中慢慢滴加足量的30%H2O2溶液,不断搅拌。此过程需保持温度在40℃左右,可能的原因是:______
(2)某兴趣小组为知道晶体中x的数值,称取1.637g纯三草酸合铁酸钾(K3[Fe(C2O4)3]xH2O)晶体配成 100ml 溶液,取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4,用浓度为 0.05000molL-1的KMnO4标准溶液进行滴定。其中,最合理的是______(选填 a、b)。由如图KMnO4滴定前后数据,可求得x=______。
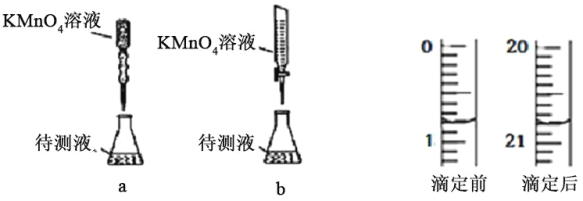
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Na+、Fe2+、Fe3+、SO42﹣、CO32﹣、I﹣、Cl﹣中的一种或多种,进行如图所示的实验,下列说法正确的是( )
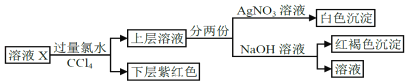
A. “下层紫红色”为I2的CCl4溶液,可用分液方法分离
B. 溶液X中有Fe2+、I﹣,可能有SO42﹣、Cl﹣、K+、Na+
C. 溶液X中一定有I﹣、Cl﹣
D. 溶液X中有I﹣,Fe2+和Fe3+两种离子中至少有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 AgNO3 溶液分别滴定浓度均为 0.01 mol/L 的KCl、K2C2O4 溶液,所得的沉淀溶解平衡图像如图所示(不考虑 C2O42-的水解)。已知 Ksp(AgCl) 数量级为 10-10。下列叙述正确的是
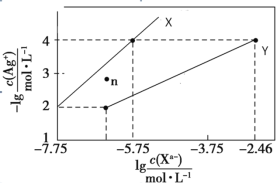
A.图中 Y 线代表的 AgCl
B.n 点表示 Ag2C2O4 的过饱和溶液
C.向 c(Cl-)=c(C2O42-)的混合液中滴入 AgNO3溶液时,先生成 AgCl 沉淀
D.Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数为 10-0.71
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是二氧化氯(ClO2)泡腾片的主要成分。实验室以氯酸钠(NaClO3)为原料先制得ClO2,再制备NaClO2粗产品,其流程如图:
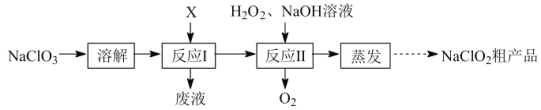
已知:①ClO2可被NaOH溶液吸收,反应为2ClO2+2NaOH=NaClO3+NaClO2+H2O。
②无水NaClO2性质稳定,有水存在时受热易分解。
(1)反应Ⅰ中若物质X为SO2,则该制备ClO2反应的离子方程式为___。
(2)实验在如图-1所示的装置中进行。
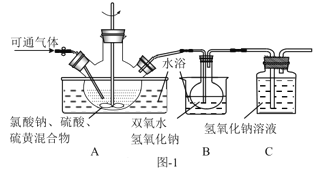
①若X为硫磺与浓硫酸,也可反应生成ClO2。该反应较剧烈。若该反应在装置A的三颈烧瓶中进行,则三种试剂(a.浓硫酸;b.硫黄;c.NaClO3溶液)添加入三颈烧瓶的顺序依次为___(填字母)。
②反应Ⅱ中双氧水的作用是___。保持反应时间、反应物和溶剂的用量不变,实验中提高ClO2吸收率的操作有:装置A中分批加入硫黄、___(写出一种即可)。
(3)将装置B中溶液蒸发可析出NaClO2,蒸发过程中宜控制的条件为___(填“减压”、“常压”或“加压”)。
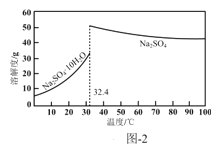
(4)反应Ⅰ所得废液中主要溶质为Na2SO4和NaHSO4,直接排放会污染环境且浪费资源。为从中获得芒硝(Na2SO4·10H2O)和石膏(水合硫酸钙),请补充完整实验方案:___,将滤液进一步处理后排放(实验中须使用的试剂和设备有:CaO固体、酚酞、冰水和冰水浴)。已知:CaSO4不溶于Na2SO4水溶液;Na2SO4的溶解度曲线如图2所示。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分。当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如右图所示位置(两侧温度相同)。则混合气体中CO和CO2的分子个数比为 ( )

A.1:1 B.1:3 C.2:1 D.3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向恒容密闭容器中投入一定量的X,反应3X(g)2Y(g)+Z(g)+W(s),△H=-QkJmol-1,反应已达到平衡的标志是( )
A. 混合气体的密度不再改变B. 混合气体的压强不再变化
C. 反应混合物中![]() 不再改变D.
不再改变D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com