
【题目】三草酸合铁酸钾K3[Fe(C2O4)3]xH2O晶体是一种亮绿色的晶体,是制备负载型活性铁催化剂的主要原料,也是一种有机反应良好的催化剂。已知M(K3[Fe(C2O4)3])=437g/mol。本实验以(NH4)2Fe(SO4)26H2O(硫酸亚铁铵晶体)为原料,加入草酸(H2C2O4)制得草酸亚铁(FeC2O4)后,在过量的草酸根(C2O42-)部分实验过程如下:
![]()
(1)在沉淀A中加入饱和K2C2O4溶液,并用40℃左右水浴加热,再向其中慢慢滴加足量的30%H2O2溶液,不断搅拌。此过程需保持温度在40℃左右,可能的原因是:______
(2)某兴趣小组为知道晶体中x的数值,称取1.637g纯三草酸合铁酸钾(K3[Fe(C2O4)3]xH2O)晶体配成 100ml 溶液,取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4,用浓度为 0.05000molL-1的KMnO4标准溶液进行滴定。其中,最合理的是______(选填 a、b)。由如图KMnO4滴定前后数据,可求得x=______。
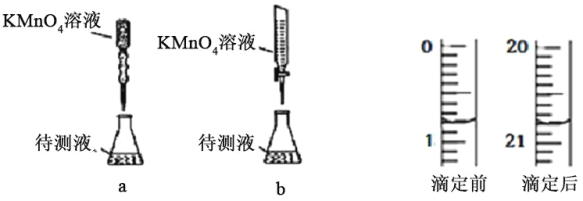
【答案】适当提高温度以加快反应速率,若温度太高则H2O2分解 b 3
【解析】
由制备流程可知,硫酸亚铁加入稀硫酸抑制Fe2+水解,然后与草酸发生(NH4)2Fe(SO4)2·6H2O+H2C2O4═FeC2O4↓+(NH4)2SO4+H2SO4+6H2O,用过氧化氢将草酸亚铁氧化为K3[Fe(C2O4)3],发生2FeC2O4+H2O2+3K2C2O4+H2C2O4═2K3[Fe(C2O4)3]↓+2H2O,溶液C含K3[Fe(C2O4)3],蒸发浓缩、冷却结晶得到晶体。
(1)在沉淀A中加入饱和K2C2O4溶液,并用40℃左右水浴加热,再向其中慢慢滴加足量的30%H2O2溶液,不断搅拌,此过程需保持温度在40℃左右,可能的原因是适当提高温度以加快反应速率,若温度太高则H2O2分解;
(2)KMnO4标准溶液具有强氧化性,可氧化橡胶,应选酸式滴定管,只有图b合理;图中消耗高锰酸钾的体积为20.80mL-0.80mL=20.00mL,由2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O可知,K3[Fe(C2O4)3]xH2O物质的量为0.02L×0.05mol/L×![]() ×
× ![]() ×
×![]() =0.0033mol,M=
=0.0033mol,M=![]() =496g/mol,则39×3+(56+280×3)+18x=496,解得x=3。
=496g/mol,则39×3+(56+280×3)+18x=496,解得x=3。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】Zewail创立的飞秒(![]() )化学研究了极短时间内的反应历程,巧妙地解决了如何确定反应起点问题。例如
)化学研究了极短时间内的反应历程,巧妙地解决了如何确定反应起点问题。例如![]() 与
与![]() 的反应过程片段为:
的反应过程片段为:![]() 。下列有关说法正确的是( )
。下列有关说法正确的是( )
A.中间产物![]() 属于有机化合物
属于有机化合物
B.反应起点为![]() 离解为H和I自由基,终点为
离解为H和I自由基,终点为![]() 自由基与I自由基结合
自由基与I自由基结合
C.![]() 经1000fs离解为
经1000fs离解为![]() 自由基和
自由基和![]() ,说明
,说明![]() 与
与![]() 的反应速率极快
的反应速率极快
D.飞秒化学展现的反应历程为“化学反应实质是旧键断裂和新键形成”提供有力证据
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列说法正确的是( )
A.1 mol羟基(-OH)中含7NA个电子
B.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
C.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D.6.2g白磷(分子式为P4)中所含P—P键的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、一定温度下,某容器中加入足量的碳酸钙发生反应:CaCO3(s)CaO(s)+CO2(g) △H>0;一段时间后达到平衡。
(1)该反应的化学平衡常数表达式为K=______; 为了提高CO2的生成率,可采取的措施______
A.减压B.升温C.增加碳酸钙的量D.转移出CO2
(2)对于该反应,下列说法正确的是______
A.CaCO3(s)加热分解生成CaO(s)和CO2(g),△S>0
B.将容器缩小为原来的一半,平衡不移动
C.将容器扩大为原来的两倍,平衡发生移动,再次平衡后,气体密度不变
D.增大压强,平衡逆向移动,K值减小
Ⅱ、在恒温恒压密闭容器中通入CO和H2O各1mol发生反应CO(g)+H2O(g)CO2(g)+H2(g),当反应达到平衡后,维持温度与压强不变,t1 时再通入各1 mol的CO 和H2O 的混合气体,请在下图中画出正反应和逆反应速率在t1后随时间t变化的曲线图。
 ____________
____________
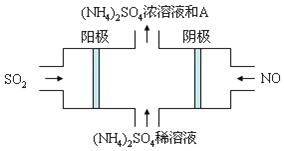
Ⅲ、雾霾的组成成分复杂,包括数百种大气化学颗粒物与气体。图电解装置可将雾霾中的SO2、NO转化为(NH4)2SO4,阴极的电极反应式是______,物质A是______(填名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某矿物的主要成分X(仅含三种元素)的组成,某兴趣小组进行了如下实验:
①取55.2g固体X在空气存在下高温煅烧,有刺激性气味的气体产生(标况下为13.44L),该气体能使品红溶液褪色。
②高温煅烧后的固体用磁分离技术进行分离,得到19.2g红色固体单质和23.2g黑色固体。
③将23.2g固体溶于稀硫酸,再加氢氧化钠,将所得沉淀充分灼烧,得到24g红棕色固体。已知各步反应试剂均过量,请回答:
(1)X化学式为______
(2)写出X在空气存在下高温煅烧的化学反应方程式______
(3)写出X高温煅烧后的气体通入碘水中发生的离子反应方程式______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):
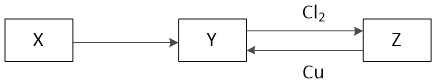
(1)若X是一种生活中使用量最大的金属单质
①写出Z与Cu反应的离子方程式:_____
②如何设计实验检验Z中阳离子:_____
(2)若X是一种非金属单质,常温下为固体,Y是一种能使品红溶液褪色且加热后又能恢复原来颜色的化合物。
①写出构成X单质的元素在元素周期表中的位置:_____
②写出Z与Cu反应的化学方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下:
(1)0.5 mol HCl占有的体积是__________L。
(2)33.6 L H2的摩尔质量是__________。
(3)在9.5 g某二价金属的氯化物固体中含有0.2 mol Cl-,将此固体加水溶解稀释为100毫升,则此氯化物的摩尔质量为_________此氯化物溶液的物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池, 装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
⑴(8分)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则

①电解池中X极上的电极反应式是 。
在X极附近观察到的现象是 。
②Y电极上的电极反应式是 ,
检验该电极反应产物的方法是 。
⑵(6分)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是
②Y电极的材料是 ,电极反应式是
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com