
【题目】工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的流程如下:
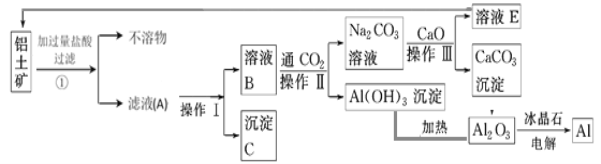
请回答下列问题:
(1)操作Ⅰ、操作Ⅱ、操作Ⅲ都用到的玻璃仪器有______________________ 。
(2)写出滤液A中一种溶质与过量NaOH溶液反应进入滤液B中的离子方程式_______________________________。
(3)若步骤①中没有过滤操作而直接进入步骤②,对后面操作将产生的影响是_______________________________。
(4)写出由溶液B生成Al(OH)3的离子方程式:_______________________________。
(5)工艺流程中涉及氧化还原反应的化学方程式为_______________________________。
(6)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有 (填化学式)。用此法制取铝的副产品是 (填化学式)。
【答案】
(1)烧杯、漏斗、玻璃棒;
(2)Al3++4OH-=AlO2-+2H2O
(3)产品中引入SiO2杂质;
(4)2AlO2-+CO2+3H2O===2Al(OH)3↓+CO32-
(5)2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
(6)CaO和CO2 Fe2O3和O2
【解析】
试题分析:(1)操作Ⅰ、操作Ⅱ、操作Ⅲ都是过滤,过滤需要烧杯、漏斗、玻璃棒,故答案为:烧杯、普通漏斗、玻璃棒;
(2)滤液A中Al3+与过量NaOH溶液反应生成AlO2-进入滤液B,反应的离子方程式为Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O;
(3)若步骤①中没有过滤操作而直接进入步骤②,产品中引入SiO2杂质,故答案为:产品中引入SiO2杂质;
(4)Na[Al(OH)4]溶液中通入CO2生成Al(OH)3沉淀和Na2CO3,其离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,故答案为:2AlO2-+CO2+3H2O===2Al(OH)3↓+CO32-;
(5)只有电解熔融Al2O3的反应属于氧化还原反应,反应的方程式为2Al2O3(熔融)![]() 4Al+3O2↑,故答案为:2Al2O3(熔融)
4Al+3O2↑,故答案为:2Al2O3(熔融)![]() 4Al+3O2↑;
4Al+3O2↑;
(6)生成的CaCO3受热分解得到CaO、CO2,可见CaO、CO2可循环使用,操作Ⅰ所得的Fe2O3和电解熔融Al2O3得到的O2为副产品,故答案为:CaO和CO2;Fe2O3和O2。


科目:高中化学 来源: 题型:
【题目】硫酸性质是中学化学学习的重点。请回答下列问题:
(1)中学化学中利用物质与浓硫酸共热可制备SO2气体,写出用浓硫酸还可制备不同类别的气体的名称: (写一种)。
(2)某化学兴趣小组为探究铜与浓硫酸的反应以及SO2的性质,用下图所示装置进行有关实验。
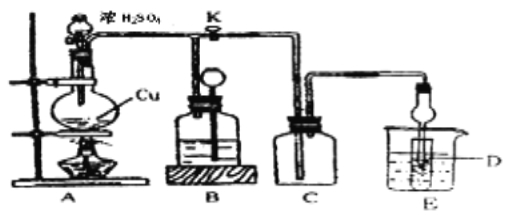
①装置B的作用是贮存多余的气体。B中应放置的液体是_______(填序号)
a.饱和Na2SO3溶液 b.酸性 KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
②反应完毕后,烧瓶中还有一定量的余酸,使用足量的下列药品不能用来证明反应结束后的烧瓶中的确有余酸的是____(填序号)。
a.Fe粉 b.BaCl2溶液 c.CuO d.Na2CO3溶液
③实验中某学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,该反应的化学方程式是_________。
④为验证二氧化硫的还原性,C中盛有氯水,充分反应后,取C中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”或“Ⅲ”);C中发生反应的离子方程式为 。D中盛有氢氧化钠溶液,当通入二氧化硫至试管D中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
(3)利用FeCl3溶液的氧化性也可以吸收SO2。该反应的离子方程式是 。检验FeCl3是否完全被还原的方法为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏的元素高达80多种,是人类财富的重要集散地。下图是对海水资源的综合利用的示意图。
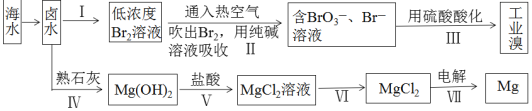
请回答下列问题:
(1)地球上99%以上的溴元素存在于海洋中,资料显示海水中溴的含量约为![]() 。上图中制备溴涉及步骤I、II、III,分别写出步骤II和步骤III中反应的离子方程式: 、 。
。上图中制备溴涉及步骤I、II、III,分别写出步骤II和步骤III中反应的离子方程式: 、 。
(2)制备镁的工艺中,从卤水到![]() 经历了
经历了![]() 的过程,生成
的过程,生成![]() 的过程看似多余,其实该过程的作用是 。
的过程看似多余,其实该过程的作用是 。
(3)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气的冷却剂的是 (填字母序号)。
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.三氧化硫的水溶液能导电,所以三氧化硫是电解质
B.自由移动离子数目多的电解质溶液导电能力不一定强
C.硫酸氢钠晶体中有自由移动的
D.甲烷属于非电解质,但其水溶液能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库。目前,世界各国都在研究如何充分利用海洋资源。全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg·L-1。其工业提取法有:
Ⅰ.空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴。该方法涉及的反应有:①Cl2+2Br-===Br2+2Cl-
②3Br2+3C![]() ===Br
===Br![]() +5Br-+3CO2↑;
+5Br-+3CO2↑;
③Br![]() +5Br- +6H+===3Br2+3H2O
+5Br- +6H+===3Br2+3H2O
其中②中的氧化剂是________,③中的还原剂是________。
Ⅱ.空气吹出SO2吸收法。该方法基本同(Ⅰ),只是将吹出的溴用SO2溶液来吸收,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。
写出溴与二氧化硫反应的化学方程式_________________________________________________。
Ⅲ.溶剂萃取法。该法是利用单质溴在水中和萃取剂中溶解度的不同的原理来进行的。
实验室中萃取用到的主要实验仪器名称是_______________________。
下列可以用于海水中溴的萃取的试剂是________(填序号)。
①乙醇 ②四氯化碳 ③硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的固体物质,只需加水就可以鉴别的一组是
A. CaCO3、BaSO4、Na2CO3 B. CuSO4、NaCl、NaCO3
C. NaCl、CuSO4、CaCO3 D. NaCl、KNO3、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高血脂严重影响人体健康,化合物E是一种临床治疗高血脂症的药物。E的合成路线如下(部分反应条件和试剂略):
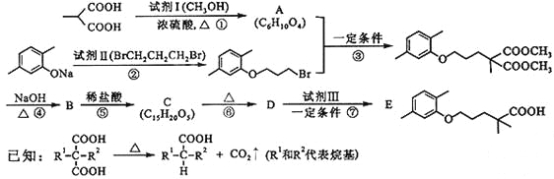
请回答下列问题:
(1)试剂Ⅰ的名称是___a___,试剂Ⅱ中官能团的名称是___b___,第② 步的反应类型是____c___。
(2)第①步反应的化学方程式是_____________。
(3)第⑥步反应的化学方程式是_____________。
(4)第⑦步反应中,试剂Ⅲ为单碘代烷烃,其结构简式是_________ 。
(5)C的同分异构体在酸性条件下水解,生成X、Y和CH3(CH2)4OH。若X含有羧基和苯环,且X和Y的核磁共振氢谱都只有两种类型的吸收峰,则X与Y发生缩聚反应所得缩聚物的结构简式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.B.C.D.E.F六种短周期元素的原子序数依次增大。已知A.C.F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的符号A___________,D___________,E___________;
(2)用电子式表示B、F形成的化合物___________;
(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式_____________;
(4)D的固态氧化物是________晶体。含n mol D的氧化物的晶体中含D-O共价键为_______mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是重要的化工原料,也是应用广发的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00 mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 mol O2,则反应前密封舱内H2O的量应该是多少?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com