
【题目】一定条件下,固定容积的密闭容器中发生反应H2(g)+I2(g)![]() 2HI(g)ΔH<0,达到平衡时,下列说法正确的是( )
2HI(g)ΔH<0,达到平衡时,下列说法正确的是( )
A.向容器中加入惰性气体,平衡向右移动
B.加入催化剂,HI的产率增大
C.降低温度,H2的转化率减小
D.无论平衡正向或是逆向移动时,混合气体的平均分子量不变
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】以铬酸钾(K2CrO4)为原料用电化学法制备K2Cr2O7的装置如图,下列说法正确的是
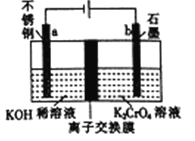
A. a极的电极反应为:2H2O+2e-=2OH-+H2↑
B. 电解过程中氢氧化钾溶液的浓度保持不变
C. b极上CrO42-发生氧化反应生成Cr2O72-
D. 电解过程中H+从右侧通过离子交换膜迁移到左侧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯和综合应用工艺如下:
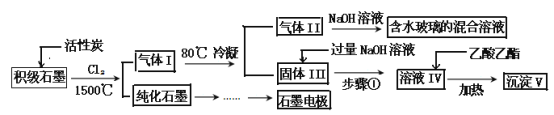
(注:SiCl4的沸点是57.6C,金属氯化物的沸点均高于150C)
(1)向反应器中通入Cl2前,需通一段时间的N2,主要目的是 。
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。气体I中的氯化物主要为 。由气体II中某物质得到水玻璃的化学方程式为 。
(3)步骤①为:搅拌、 。所得溶液IV中阴离子有 。
(4)由溶液IV生成沉淀V的总反应的离子方程式为 。100kg初级石墨最多可获得V的质量为 kg。
(5)石墨可用于自然水体中铜件的电化学防腐,完成图防腐示意图,并作相应标注。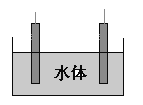
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法,正确的是( )
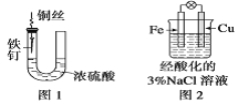

A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D、图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
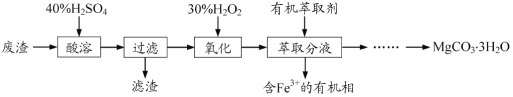
(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol–1
Mg2SiO4(s)+4H+(aq)===2 Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol–1
酸溶需加热的目的是______;所加H2SO4不宜过量太多的原因是_______。
(2)加入H2O2氧化时发生发应的离子方程式为___________。
(3)用如图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。
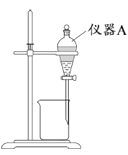
①实验装置图中仪器A的名称为_______。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,______,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s)为自发进行的氧化还原反应,将其设计成如右图所示的原电池,下列说法中正确的是( )

A. 铜电极是正极,其电极反应为Cu-2e-===Cu2+
B. 当铜电极质量减少0.64 g时,电解质溶液中有0.02 mol电子通过
C. 装置盐桥中可装有含琼脂的KCl饱和溶液
D. 银电极上发生还原反应,电极质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、M为元素周期表中前四周期的元素,其原子序数依次增大。X与W、Z与R是分别同族元素;X原子的第一电离能小于同周期前一族元素的原子;Z元素基态原子的核外有3个未成对电子;M元素的单质化学性质稳定,耐腐蚀,其单质及合金是一种优良的航天、航空材料,M的基态原子核外有2个未成对电子。请回答下列问题:
⑴NaZ3可应用于汽车安全气囊,当汽车发生碰撞时,气囊中的NaZ3迅速分解产生大量Z 的单质气体,从而使安全气囊瞬间充气弹出,减轻了乘员受到的伤害。基态Z原子价电子的电子排布图为_____________。与Z3-互为等电子体的分子的化学式为______________(写一个即可),Z3-的空间构型是__________。
⑵W元素可形成[WF6]3-、[WCl4]-配离子,而X只能形成[XF4]-配离子,由此可知决定配合物中配位数多少的因素之一是________________;
⑶已知Y的最高价含氧酸根离子与Na+、K+、NH4+形成的酸式盐溶解度都小于其正盐的溶解度,原因是HCO3-之间以________(填作用力)作用形成长链,减小了HCO3-与水分子之间的作用导致溶解度降低;
⑷R元素通常有白、红、黑三种颜色的单质,其中最稳定的同素异形体G在通常状态下是一种黑色有金属光泽的晶体,G在储能、电子和光伏发电等领域有着广泛的应用前景,是一种比石墨烯更优秀的新型材料。晶体G具有与石墨类似的层状结构,如图一所示。下列有关G的说法正确的是_______________;
A.G中R原子杂化方式为sp3杂化
B.G中层与层之间的作用力是配位健
C.与石墨类似,G的每一层中R原子都在同一平面上
D.R元素三种常见的单质中,G的熔沸点最高
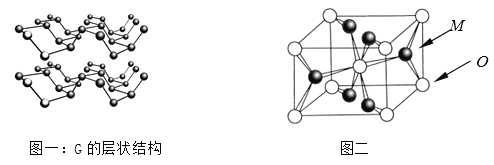
⑸M与O形成的离子晶体在自然界中存在三种形态,其中金红石型是三种形态中最稳定的一种,其晶胞如图二所示,则M、O配位数之比为________;影响离子晶体结构类型的因素有_____________、____________、键性因素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)根据结构对有机物进行分类,有助于对其性质的掌握。
a.![]() b.
b.![]() c.
c.![]()
上述有机物与苯互为同系物是________(填字母代号),写出苯与液溴发生反应的化学方程式:_______________________________________。
(2)苯在一定条件下可与浓HNO3发生如下反应:C6H6+HO—NO2![]() C6H5-NO2+H2O,该反应的反应类型是____________________。
C6H5-NO2+H2O,该反应的反应类型是____________________。
(3)生活中常用食醋除去暖瓶内的水垢(主要成分是CaCO3),反应的化学方程式为2CH3COOH+CaCO3===(CH3COO)2Ca+CO2↑+H2O。通过这个事实,你得出醋酸与碳酸的酸性强弱关系是:醋酸________碳酸(填“>”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com