
【题目】为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
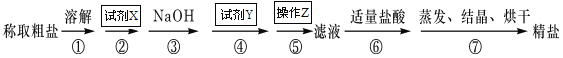
(1)试剂X的化学式为: ,试剂Y的化学式为: ,操作Z的名称: 。
(2)判断试剂X已过量的方法是
(3)第④步中,有关的离子方程式是 。
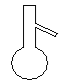
(4)下列仪器中,蒸发结晶时会用到的是 (写仪器名称)
![]()
![]()
![]()
(5)为检验精盐纯度,需配制1000mL 0.2 mol/L NaCl(精盐)溶液,回答下列问题:
①人们常将配制过程简述为以下各步骤:A.冷却;B.称量;C.洗涤;D.定容;E.溶解;F.摇匀;G.转移;H.装瓶。其正确的操作顺序应是_______ (填序号)。
A.B E F G C G D H A B.B E G A C G F D H
C.B E A G C G D F H D.B E A G C G D H F
②若定容时,仰视,会造成所配制的溶液浓度(填“偏高”或“偏低” ) 。
【答案】(1)BaCl2Na2CO3 过滤
(2)取少量上层澄清液于试管中,滴加氯化钡溶液,不再产生白色沉淀,证明氯化钡溶液已滴加过量. 或取少量上层澄清液于试管中,滴加稀硫酸,产生白色沉淀,证明氯化钡溶液已滴加过量;
(3)Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓;
(4)蒸发皿 (5)C ( 6 )偏低
【解析】试题分析:分析题给实验方案知为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,先将粗盐溶解,加入过量氯化钡溶液除去其中的SO42—,再加入过量的氢氧化钠溶液除去Mg2+,再加过量的碳酸钠溶液除去Ca2+和过量的Ba2+,过滤,除去不溶物,向滤液中加适量盐酸除去过量的氢氧化钠和碳酸钠,蒸发、结晶、烘干得精盐。
(1)试剂X的化学式为BaCl2,试剂Y的化学式为Na2CO3,操作Z的名称是过滤。
(2)判断试剂X已过量的方法是取少量上层澄清液于试管中,滴加氯化钡溶液,不再产生白色沉淀,证明氯化钡溶液已滴加过量. 或取少量上层澄清液于试管中,滴加稀硫酸,产生白色沉淀,证明氯化钡溶液已滴加过量。
(3)第④步中,加入碳酸钠溶液除去粗盐中的Ca2+和过量的Ba2+,有关的离子方程式是Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓。
(4)蒸发结晶时会用到的是蒸发皿。
(5)①配制1000mL 0.2 mol/L NaCl(精盐)溶液的实验步骤为称量、溶解、冷却、转移、洗涤、转移、定容、摇匀、装瓶,选C;②若定容时,仰视,所配溶液的体积偏大,会造成所配制的溶液浓度偏低。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室制溴苯可用如图装置。回答下列问题:
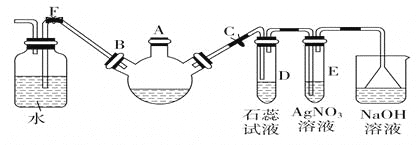
(1)关闭F夹,打开C夹,向装有少量苯的三口烧瓶的A口加少量溴,再加少量铁屑,塞住A口,则三口烧瓶中发生的有机化学反应方程式为_______________________。
(2)D试管内出现的现象为________________;E试管内出现的现象为________________。
(3)待三口烧瓶中仍有气泡冒出时打开F夹,关闭C夹,可看到的现象是_____________________。
(4)从溴苯中除去溴,用NaOH溶液处理后再洗涤,反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数,下列说法中正确的是( )
A.NA个氢气分子所占的体积为22.4L
B.2NA个二氧化碳分子的质量为44g
C.32g O2所含的氧原子数目是2NA
D.17g氨气中所含原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 氯化钠可以在水分子的作用下电离成钠离子和氯离子
B. 硫酸钡难溶于水,所以硫酸钡属于弱电解质
C. 溶于水后能电离出氢离子的化合物都是酸
D. 二氧化碳溶于水,溶液能导电,故二氧化碳属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应条件的控制中不恰当的是( )
A.为防止铁生锈,在其表面涂一层防锈油漆
B.为防止火灾,在面粉厂、加油站等场所要严禁烟火
C.为加快KClO3的分解速率,加入MnO2
D.为提高H2O2的分解率, 向溶液中滴加FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中W的原子核中只有6个质子;X可与W形成两种常见的气体WX和WX2;Y是短周期元素中原子半径最大的元素;Z与Y形成的化合物的水溶液呈中性。下列叙述正确的是( )
A. Y位于第3周期ⅦA族 B. 单质沸点:W>Y
C. 气体氢化物稳定性:W>Z D. 离子半径:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)
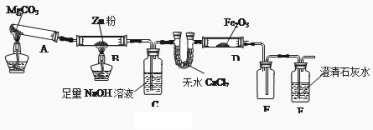
(1)MgCO3的分解产物为 。装置B中的反应方程式为 。
(2)装置C的作用是 ,处理尾气的方法为 。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
已知:Fe2+与[Fe(CN)6]3-反应生成Fe3[Fe(CN)6]2(蓝色沉淀)
①乙组得到的黑色粉末是 ;
②甲组步骤1中反应的离子方程式为 ;
③从实验安全考虑,上图装置还可采取的改进措施是 ;
④乙组步骤4中,溶液变红的原因为 ;溶液褪色可能的原因是 ,其验证方法为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200℃时,11.6gCO2和水蒸气的混合气体与过量的Na2O2充分反应后,固体质量增加了3.6g,再将反应后剩余固体冷却后加入含有Na+、HCO3-、SO42-、CO32-等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是( )
A.原混合气体的平均摩尔质量为23.2g/mol
B.混合气体与Na2O2反应过程中电子转移的物质的量为0.25mol
C.溶液中SO42-的物质的量浓度基本保持不变
D.溶液中HCO3-的物质的量浓度减小,CO32-的物质的量浓度增大,但是HCO3-和CO32-的物质的量浓度之和基本保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com