
【题目】实验室制溴苯可用如图装置。回答下列问题:
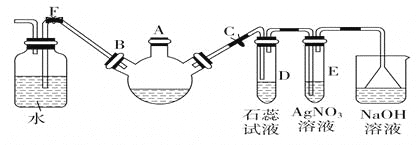
(1)关闭F夹,打开C夹,向装有少量苯的三口烧瓶的A口加少量溴,再加少量铁屑,塞住A口,则三口烧瓶中发生的有机化学反应方程式为_______________________。
(2)D试管内出现的现象为________________;E试管内出现的现象为________________。
(3)待三口烧瓶中仍有气泡冒出时打开F夹,关闭C夹,可看到的现象是_____________________。
(4)从溴苯中除去溴,用NaOH溶液处理后再洗涤,反应的离子方程式为 。
【答案】(1)![]()
(2)有白雾产生,试液变红 生成浅黄色沉淀
(3)液体倒吸,三口烧瓶中液体分层(4)Br2+2OH-===Br-+BrO-+H2O
【解析】试题分析:(1)苯和液溴在催化剂作用下发生取代反应的方程式为![]() ;
;
(2)反应生成的溴化氢易挥发,溶于水显酸性,则D试管内出现的现象为有白雾产生,试液变红;溴化氢和硝酸银溶液反应产生溴化银沉淀,所以E试管内出现的现象为生成浅黄色沉淀;
(3)待三口烧瓶中仍有气泡冒出时打开F夹,关闭C夹,由于压力差的作用,会产生倒吸现象。又因为溴苯不溶于水,所以可看到的现象是液体倒吸,三口烧瓶中液体分层;
(4)根据氯气和氢氧化钠反应的原理可知溴和氢氧化钠反应的方程式为Br2+2OH-===Br-+BrO-+H2O。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】甲乙两同学分别对含+4价硫元素的物质性质进行了探究。
(1)甲用下图装置进行实验(气密性已检验,加热和夹持装置已略去)。实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4。
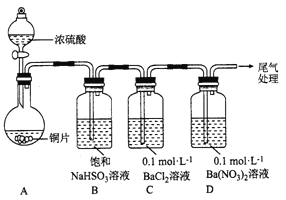
① A中反应的化学方程式是______________。
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现由色沉淀的过程中,D溶液中NO3-浓度几乎不变。甲据此得出结论:D中出现白色沉淀的主要原因是__________________。
(2)乙用如下实验对含+4价疏元素的物质性质继续进行探究。
序兮 | 实验搡作 | 实聆现象 |
1 | 取0.3g纯净Na2SO3固体,向其中加人10mL 2 mol/L盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡,滴入BaCl2溶液后,开始无现象,4 min后,溶液变浑浊 |
2 | 取0.3g纯净Na2SO3固体,向其中加入10mL 2 mol/L HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2 h后,溶液变浑浊 |
3 | 取0.3g纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
①用离子方程式解释实验1中产生现象的原因:________________。
② 由实验1、2、3对比,可以得到推论:________________。
③乙通过査阅资料发现.Na+对实验1和2中出现浑浊的时间无影响,于是进一步探究Cl-和 NO3-对其的影响:
序号 | 实验操作 | 实验现象 |
4 | 取____固体混合物,向其中加入10mL2 mol /LHNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;:滴入BaCl2溶液后,开始无现象,20 min后,溶液变浑浊 |
i.实验2和4对比,乙获得推论:C1-的存在可以加快溶液中+4价硫元索的氧化;
ii.实验I和4对比,乙获得推论: ______________。
④通过以上实验,乙同学认为,确定某溶液中含有SO42-的实验方案:取待测液,向其中先滴加____________ (填字母序号)。
a.2 mol/L盐酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
B.2 mol/L盐酸,再滴加BaCl2溶液,立即出现白色沉淀
C.2 mol/L硝酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
D.2 mol/L硝酸,再滴加BaCl2溶液,立即出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列原子构成的单质中既能与稀硫酸反应,又能与烧碱溶液反应,且都产生H2的是( )
A. 核内无中子的原子
B. 外围电子排布为3s23p2
C. 最外层电子数等于倒数第三层上的电子数的原子
D. N层上无电子,最外层上的电子数等于电子层数的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当1 g氨气完全分解为氮气、氢气时,吸收2.72 kJ的热量,则下列热化学方程式正确的是( )
①N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ/mol
②N2(g)+3H2(g)=2NH3(g) ΔH=-46.2 kJ/mol
③NH3(g)=![]() N2(g)+
N2(g)+![]() H2(g) ΔH=+46.2 kJ/mol
H2(g) ΔH=+46.2 kJ/mol
④2NH3(g)=N2(g)+3H2(g) ΔH=-92.4 kJ/mol
A.①② B.①③ C.①②③ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有CaCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是( )
A. Ksp(CaCO3) B. c(Ca2+) C. c(H+) D. c(CO32)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】
化合物H的分子中含有醛基和酯基,H可以用C和F在一定条件下合成(如图);
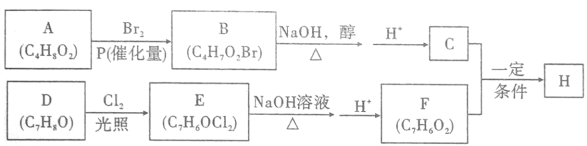
已知以下信息:
①A的核磁共振氢谱中有三组峰;且能与饱和碳酸氢钠溶液反应放出CO2。
②
③化合物D苯环上的一氯代物只有两种。
④通常同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
(1)A的化学名称_____________________;(系统命名法)
(2)B的结构简式为_____________________;
(3)D生成E的化学方程式为_____________________,该反应类型为___________;
(4)F的结构简式为______________;
(5)H在一定条件下反应生成高聚物的化学方程式为______________;
(6)F的同系物G比F相对分子质量大14,G的同分异构体中能同时满足如下条件:①苯环上只有两个取代基;不能使FeCl3溶液显色,共有_______种(不考虑立体异构)。G的一个同分异构体被酸性高锰酸钾溶液氧化后核磁共振氢谱为两组峰,且峰面积比为2:1,写出G的这种同分异构体的结构简式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO (OH)2,因此配制KMnO4标准溶液的操作是: (1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸1h; (2)用微孔玻璃漏斗过滤除去难溶的MnO (OH)2; (3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处; (4)利用氧化还原滴定方法,在700C-800C条件下用基准试剂 (纯度高、式量较大、稳定性较好的物质)溶液标定其浓度。请回答下列问题:
(1)将溶液加热并保持微沸1h的目的是 。
(2)如何保证在700C~800C条件下进行滴定操作: 。
(3)准确量取一定体积的KMnO4溶液用 (填仪器名称)。
(4)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用 (填序号)。
A.H2C2O4·2H2O | B.FeSO4 | C.浓盐酸 | D.Na2SO3 |
(5)若准确称取Wg你选的基准试剂溶于水配成500mL水溶液,取25.00mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液VmL。问:
①滴定终点标志是 ;
②所配制KMnO4标准溶液的物质的量浓度为 ;
(6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量,测得的浓度值将 (填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
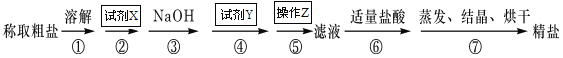
(1)试剂X的化学式为: ,试剂Y的化学式为: ,操作Z的名称: 。
(2)判断试剂X已过量的方法是
(3)第④步中,有关的离子方程式是 。
(4)下列仪器中,蒸发结晶时会用到的是 (写仪器名称)
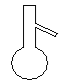
![]()
![]()
![]()
(5)为检验精盐纯度,需配制1000mL 0.2 mol/L NaCl(精盐)溶液,回答下列问题:
①人们常将配制过程简述为以下各步骤:A.冷却;B.称量;C.洗涤;D.定容;E.溶解;F.摇匀;G.转移;H.装瓶。其正确的操作顺序应是_______ (填序号)。
A.B E F G C G D H A B.B E G A C G F D H
C.B E A G C G D F H D.B E A G C G D H F
②若定容时,仰视,会造成所配制的溶液浓度(填“偏高”或“偏低” ) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com