
【题目】下列有机物的命名正确的是( )
A.二溴乙烷: ![]()
B.3﹣乙基﹣1﹣丁烷: ![]()
C.2,2,3﹣三甲基戊烷: 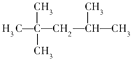
D.2﹣甲基﹣2,4﹣己二烯: ![]()
【答案】D
【解析】解:A、卤代烃命名时,要选含官能团的最长的碳链为主链,从离官能团最近的一端给主链上的碳原子编号,故两个溴原子分别在1号和2号碳原子上,故为1,2﹣二溴乙烷,故A错误;
B、烷烃命名时,要选最长的碳链为主链,故主链上有5个碳原子,为戊烯,从离支链近的一端给主链上碳原子编号,故在3号碳原子上有一个甲基,在1号和2号碳原子间有碳碳双键,故名称为3﹣甲基﹣1﹣戊烯,故B错误;
C、烷烃命名时,要选最长的碳链为主链,故主链上有5个碳原子,为戊烷,从离支链近的一端给主链上碳原子编号,当两端离支链一样近时,要从支链多的一端给主链上的碳原子编号,故名称为2,2,4﹣三甲基戊烷,故C错误;
D、烯烃命名时,要选含官能团的最长的碳链为主链,故主链上有6个碳原子,故为己二烯,从离官能团最近的一端给主链上的碳原子编号,并表示出官能团的位置,故在2号碳原子上有一个甲基,在2号和3号碳原子间、4号和5号碳原子间各有一条双键,故名称为2﹣甲基﹣2,4﹣己二烯,故D正确;
故选D.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在航天飞机返回地球大气层时,为防止其与空气剧烈摩擦而被烧毁,需在航天飞机外表面安装保护层。该保护层的材料可能为
A. 铝合金 B. 合金钢 C. 新型陶瓷 D. 塑料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(计算pH时假定溶液体积没有变化):
①向其中一份固体中加入100 mL2.0 mol/L的NaOH溶液,加热使其充分反应后过滤,测得滤液的pH=14。
②向另一份固体中加入140 mL 4.0 mol/L的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且pH=0。
(1)写出该铝热反应的化学方程式_____________________________
(2)这包铝热剂中铝粉的质量为_________ , 氧化铁粉末的质量______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含49g H2SO4的某浓硫酸加水,配成500ml溶液.
(1)求所得硫酸的物质的量浓度
(2)若将此溶液稀释成1L溶液,取出0.1L再与65g的锌反应,求可以得到标准状况下氢气的体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列事实:
① Cr2O3溶于KOH溶液得到KCrO2溶液,Cr2O3溶于硫酸溶液得到Cr2(SO4)3溶液;
② 向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③ 将K2Cr2O7溶液滴加到淀粉-KI溶液中,溶液变蓝。下列叙述不正确的是
A. 实验①证明Cr2O3是两性氧化物
B. 实验②中H2O2是氧化剂,K2Cr2O7是氧化产物
C. 实验③证明氧化性:Cr2O72->I-
D. 实验③中,若生成1.27gI2,则反应中转移0.01mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外研究性学习小组拟用粗盐(含有少量杂质包括:泥沙、CaCl2、MgCl2、Na2SO4)经提纯后,配制0.4mol/L 450mL NaCl溶液.他们设计并实施了如下实验,请根据已学过的知识回答下列问题:
(1)取一定量的粗盐置于烧杯中加水溶解,所加的水量应为: . (填选项)
A.多加水配成较稀的溶液
B.加入适量的水至能溶解的固体溶解即止
(2)将(1)中配制的粗盐悬浊液过滤后取滤液加入过量的除杂试剂,如果除杂试剂可从下列六种溶液中选择 ①Na2CO3溶液 ②KOH溶液 ③AgNO3溶液 ④NaOH溶液 ⑤NaHCO3溶液 ⑥BaCl2溶液,则正确的试剂和加入的顺序应为 . (填选项,多选、少选、错选都不得分)
A.①②③B.②⑥⑤C.④⑥①D.①④⑥E.⑥①④F.⑥②⑤
将所得的悬浊液经过滤后取滤液加入足量的盐酸,充分反应后对混合溶液进行蒸发、过滤、洗涤、干燥操作,得到纯净的NaCl固体,请描述在蒸发操作过程中玻璃棒的作用是 .
(3)利用(2)中所得的NaCl固体继续配制所需溶液.在托盘天平上称量g NaCl固体.配制过程中需要使用的玻璃仪器有:烧杯、玻璃棒、和 .
(4)配制结束后同学们对实验中出现的某些错误操作,对最终配制的溶液浓度的影响进行了分析,则下列错误操作会导致最终配制溶液中NaCl的浓度相比0.4mol/L的偏差是:(填“偏大”、“偏小”、“无影响”)
①在上述(2)步中没有使用盐酸处理滤液,结果会 ,
②定容时俯视凹液面,结果会
③上下颠倒摇匀后液面低于刻度线,未及时加水至刻度线,结果会
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠是日常生活中常用的调味品。下列性质可以证明氯化钠中一定存在离子键的是
A. 常温下能溶于水 B. 水溶液能导电
C. 熔融状态能导电 D. 具有较高的熔点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com