
| A、在28 g乙烯、丙烯和聚乙烯树脂的混合物中,含有的碳原子数目为2NA |
| B、标况下,23g乙醇分子中含有共用电子对数为4NA |
| C、由两种短周期元素X和Y可组成化合物XaYb,当X的原子序数为m时,Y的原子序数可能为:m+8-a-b;m+16-a-b;m-a-b |
| D、同主族元素原子序数差可能为8、18、26、37 |
| m |
| M |
| 28g |
| 14g/mol |
| m |
| M |
| 23g |
| 46g/mol |


科目:高中化学 来源: 题型:
| A、H2、I2、HI平衡混合气加压后颜色变深 |
| B、加入催化剂有利于合成NH3的反应 |
| C、高压有利于合成NH3的反应 |
| D、500℃左右比室温更有利于合成NH3的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20℃101kPa时,气体摩尔体积约为22.4L/mol |
| B、阿伏加德罗常数只是一个数,没有单位 |
| C、摩尔是七个基本物理量之一 |
| D、在温度、压强一定时,任何具有相同微粒数的气体都具有大致相同的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种气体的压强相等 |
| B、H2比H3的质量小 |
| C、两种气体的分子数目相等 |
| D、两种气体的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32 g氧气和臭氧的混合气体中所含的原子数为2NA |
| B、常温常压下,22.4LCO2含有的分子数目为NA |
| C、标准状况下,22.4 LCCl4中含有的碳原子数目为NA |
| D、78gNa2O2与足量的水反应转移的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含NA个分子的氮气 |
| B、标准状况下3.36L甲烷 |
| C、5.4 g水(水的摩尔质量为18g?mol-1) |
| D、0.4mol三氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:
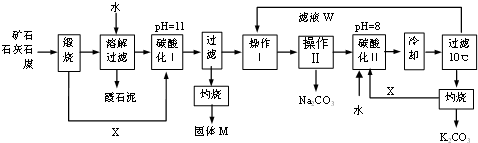

查看答案和解析>>
科目:高中化学 来源: 题型:
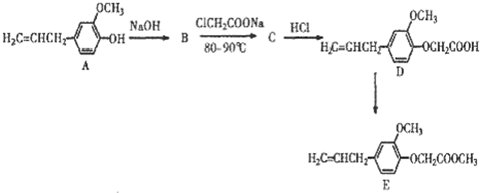
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com