
【题目】将表面已部分被氧化为氧化钠的金属钠样品5.4g放入40g水中,在标准状况下放出1.12LH2 。求:
(1)样品中金属钠的质量为____________克.
(2)若反应后溶液的体积为40mL,所得溶液的物质的量浓度为_______mol/L
【答案】2.3g 5mol/L
【解析】
(1)根据反应2Na+2H2O=2NaOH+H2↑计算;
(2)根据总质量分别计算Na和Na2O的物质的量,进而计算生成NaOH的总物质的量,可求得浓度。
(1) 2Na+2H2O=2NaOH+H2↑
46g 1mol
m(Na) 0.05mol
m(Na)=![]() =2.3g,
=2.3g,
答:原混合物中金属钠的质量为2.3g。
(2)原混合物中金属钠的质量为2.3g,则m(Na2O)=5.4g-2.3g=3.1g,n(Na)=![]() =0.1mol,
=0.1mol,
n(Na2O)=![]() =0.05mol,
=0.05mol,
则与水反应生成的总NaOH的物质的量为:n(NaOH)=0.1mol+0.05mol×2=0.2mol,c(NaOH)=![]() =5mol/L,
=5mol/L,
答:所得溶液的物质的量浓度为5mol/L。


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】700℃时,H2(g)+CO2(g)![]() H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v (H2O)为0.025 mol/(L·min),下列判断不正确的是( )
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v (H2O)为0.025 mol/(L·min),下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
C(H2)/mol/L | 0.1 | 0.2 | 0.2 |
C(CO2)/mol/L | 0.1 | 0.1 | 0.2 |
A. 平衡时,乙中CO2的转化率大于50%
B. 当反应平衡时,丙中c(CO2)是甲中的2倍
C. 温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D. 其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答以下问题:
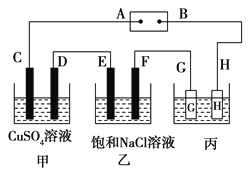
(1)电极A是__________________(填“正极”或“负极”)。
(2)甲装置中电解反应的总化学方程式是_______________。
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,求所得溶液在25℃时的pH=__________________。
(4)欲用丙装置给铜镀银。G应该是___(填“银”或“铜”),电镀液的主要成分是______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5 L某浓度的NaCl溶液中含有0.5 mol NaCl,下列对该溶液的说法中,不正确的是
A. 该溶液溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有58.5 g NaCl
C. 配制100 mL该溶液需用5.85 g NaCl
D. 量取100 mL该溶液倒入烧杯中,烧杯中的NaCl物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的电极材料分别为Pb和PbO2,电解质溶液为30% H2SO4。下图是处于工作状态的铅蓄电池示意图,若两电极的质量都增加且a极增加得更多。下列说法正确的是

A. a为铅蓄电池的正极
B. b电极发生的反应为PbO2+4H++SO42-+2e-=PbSO4+2H2O
C. 该铅蓄电池正在充电
D. 工作一段时间后,溶液的pH不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是
A. 0.1 mol·L-1 Na2CO3与0.l mol·L-1 NaHCO3溶液等体积混合:2/3 c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3)
B. 0.1 mol·L-1 Na2C2O4与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
C. 0.1 mol·L-1 CH3COONa与0.l mol·L-1 HCl 溶液等体积混合:c(Na+) = c(Cl-) > c(OH-) > c(CH3COO-)
D. 0.l mol·L-1 NH4Cl与0.l mol·L-1氨水等体积混合(pH > 7): c(NH3·H2O) > c(NH4+) > c(Cl-) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24LH2O中含有共价数目为2NA
B. NA个氧气分子与NA个氢分子的质量比为8:1
C. 8gCuO与足量H2充分反生成Cu,该反应转移的电子数为0.2NA
D. 4.6g金属钠与500mL 0.2mol/L的盐酸充分反应,转移电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳是一种用途广泛的化工基础原料。有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:

则:(1)① 不用通入O2氧化的方法除去CO的原因是 ______________________________。
②SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=________。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) ![]() CO2(g)+H2(g),已知420 ℃时,该反应的化学平衡常数K=9。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________ mol·L-1·min-1。
CO2(g)+H2(g),已知420 ℃时,该反应的化学平衡常数K=9。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________ mol·L-1·min-1。
(3)为减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NOx及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比 (空气与燃油气的体积比)的变化关系示意图如图所示:
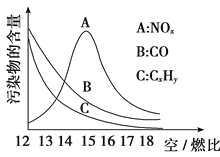
①随空/燃比增大,CO和CxHy的含量减少的原因是_____________________________。
②当空/燃比达到15后,NOx减少的原因可能是____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com