
【题目】下列实验中,实验操作、装置、现象及结论都正确的是
选项 | 实验操作或装置 | 实验现象 | 相关解释及结论 |
A. | 用两支试管各取5 mL 0.1 mol·L-1酸性KMnO4溶液,分别加入2 mL 0.1 mol·L-1和0.2 mol·L-1 H2C2O4溶液 | 两试管溶液均褪色,且加0.2 mol·L-1H2C2O4的试管中褪色更快 | 其他条件不变,H2C2O4浓度越大,化学反应速率越大 |
B. |
| 左球气体颜色加深,右球气体颜色变浅 | 勒夏特列原理 |
C. | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
D. |
| 饱和Na2CO3溶液上有透明的不溶于水的油状液体产生 | 乙酸乙酯难溶于水 |
A.AB.BC.CD.D
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态Fe2+的核外电子排布式为_________________。
(2)氟、氧、砷三种元素中电负性值由大到小的顺序是__________(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加人NH4F,发生如下反应:Fe(SCN)3+6NH4F=(NH4)3FeF6+3NH4SCN。
①(NH4)3FeF6存在的微粒间作用力除共价键外还有_________(选填序号,下同)。
a.配位键 b.氢键 c.金属键 d.离子键
②已知SCN一中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为_____________,该原子团中![]() 键与
键与![]() 个数的比值为___________________。
个数的比值为___________________。
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因:_______________________________。
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的。
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
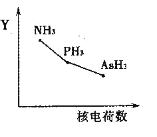
a.稳定性 b.沸点 c.R—H键能 d.分子间作用力
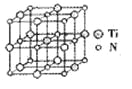
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,据此分析,这种碳氮化钛化台物的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知所用火箭推进剂为肼(N2H4)和过氧化氢(H2O2),火箭箭体一般采用钛合金材料。请回答下列问题:
(1)NH3、H2O2分子中电负性最大的元素在周期表中的位置为___,第一电离能最大的元素为___。
(2)铬的原子序数为24,其基态电子排布式为___。
(3)1molN2H4分子中含有的σ键数目为___。
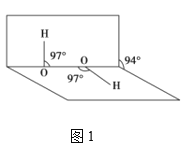
(4)H2O2分子结构如图1,其中心原子杂化轨道类型为___,估计它难溶于CS2,简要说明原因___。
(5)氮化硼晶胞如图2所示,处于晶胞顶点上的原子的配位数为___,若立方氮化硼的密度为ρgcm-3,阿伏加德罗常数为NA,则两个最近N原子间的距离为___cm。
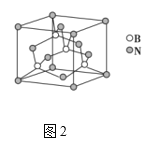
(6)如图3所示,若将A离子移到晶胞的体心,则B离子移到了___(填顶点,面心或棱心)。
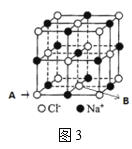
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时CuSO4的溶解度是Sg,其饱和溶液密度为dg·cm-3,物质的量浓度为cmol·L-1。向足量饱和溶液中加入mg无水CuSO4或蒸发掉ng水后恢复t℃,均能获得Wg胆矾晶体,下列关系式正确的是
A. c=![]() mol·L-1 B. S=
mol·L-1 B. S=![]() g
g
C. m=![]() g D. W=
g D. W=![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列
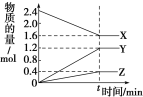
表述中正确的是
A.反应的化学方程式为2X = 3Y + Z
B.t时,正、逆反应都不再继续进行,反应达到化学平衡
C.若t=4,则0~t的X的化学反应速率为0.1 molL-1min-1
D.温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。如图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
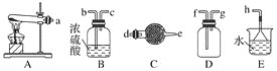
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接__、___接__,__接h;实验室用A装置制取NH3的化学方程式为___。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是___,试写出制纳米级碳酸钙的化学方程式:___。
(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图的说法不正确的是( )

A. 1mol固态碘与![]() 化合生成2molHI气体时,需要吸收5kJ的能量
化合生成2molHI气体时,需要吸收5kJ的能量
B. 2molHI气体分解生成1mol碘蒸气与![]() 时需要吸收12kJ的能量
时需要吸收12kJ的能量
C. 1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量
D. 碘蒸气与![]() 生成HI气体的反应是吸热反应
生成HI气体的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应的实验,能达到实验目的的是
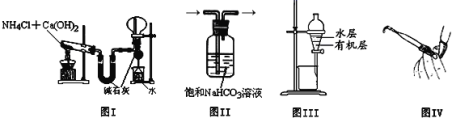
A.图I用于实验室制氨气并收集干燥的氨气
B.图II用于除去Cl2中含有的少量HCl
C.图III用于提取I2的CCl4溶液中的I2
D.图IV用于检查碱式滴定管是否漏液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka1 (H2SO3)=1.5×10-2,Ka2=1.0×10-7,Kb (NH3·H2O) =1.76×10-5,设H2SO3溶液中c(总)=c(![]() )+c(
)+c(![]() )+c(H2SO3)。室温下将氨气通入25.00 mL 0.1000 mol·L1H2SO3溶液中(忽略溶液体积变化),下列说法正确的是
)+c(H2SO3)。室温下将氨气通入25.00 mL 0.1000 mol·L1H2SO3溶液中(忽略溶液体积变化),下列说法正确的是
A.溶液中始终存在:c(![]() )+c(H+ )=c(
)+c(H+ )=c(![]() )+c(
)+c(![]() )+c(OH)
)+c(OH)
B.在NH4HSO3溶液中:c(![]() )>c(
)>c(![]() )>c(NH3·H2O)>c(H2SO3)
)>c(NH3·H2O)>c(H2SO3)
C.pH=7的溶液:c(![]() )=2c(
)=2c(![]() )+c(
)+c(![]() )
)
D.c(![]() )=2c(总)的溶液中:c(NH3·H2O)+c(OH)=c(H+ )+c(
)=2c(总)的溶液中:c(NH3·H2O)+c(OH)=c(H+ )+c(![]() )+2c(H2SO3)
)+2c(H2SO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com