
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如右图的反应关系:

(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。写出其中D与水反应生成的酸名称___________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式_____________________。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式______________________。
(4)若A是应用最广泛的金属,④反应用到A,②⑤反应均用刭同一种非金属单质。写出反应④的离子方程式______________________________。
【答案】 硫酸 4NH3+5O2![]() 4NO+6H2O AlO2-+2H2O+CO2==Al(OH)3↓+ HCO3- Fe+2Fe3+=3Fe2+
4NO+6H2O AlO2-+2H2O+CO2==Al(OH)3↓+ HCO3- Fe+2Fe3+=3Fe2+
【解析】(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质,因此A是硫,C是二氧化硫,B是H2S,D是SO3,与水反应生成硫酸;(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染,由此可以判断为NO、NO2,B为NH3,氨气能被氧化成NO,所以C为NO,D为NO2,A是单质,则A为N2,③反应的化学方程式为4NH3+5O2![]() 4NO+6H2O;(3)D物质具有两性推断D为Al(OH)3,④反应是通入过量的一种引起温室效应的主要气体,说明C为偏铝酸盐,气体是CO2,②③反应均要用强碱溶液,可判断A为Al,反应④的离子方程式为AlO2-+2H2O+CO2==Al(OH)3↓+HCO3-;(4)若A是应用最广泛的金属,推断为Fe,④反应用到A,②⑤反应均用到同一种非金属单质,推断为Cl2,则可判断C为FeCl3,D为FeCl2,反应④的离子方程式为Fe+2Fe3+=3Fe2+。
4NO+6H2O;(3)D物质具有两性推断D为Al(OH)3,④反应是通入过量的一种引起温室效应的主要气体,说明C为偏铝酸盐,气体是CO2,②③反应均要用强碱溶液,可判断A为Al,反应④的离子方程式为AlO2-+2H2O+CO2==Al(OH)3↓+HCO3-;(4)若A是应用最广泛的金属,推断为Fe,④反应用到A,②⑤反应均用到同一种非金属单质,推断为Cl2,则可判断C为FeCl3,D为FeCl2,反应④的离子方程式为Fe+2Fe3+=3Fe2+。


科目:高中化学 来源: 题型:
【题目】根据化学方程式:(1)2Fe3++2I-=2Fe2++I2;(2)Br2+2Fe2+=2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是( )
A. Br-、Fe2+、I- B. I-、Fe2+、Br-
C. Br2、Fe3+、I2 D. Br-、I-、Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 将硫酸钾、硫酸铝、硫酸钾铝三种盐混合溶于硫酸酸化的水中,测得c(SO42-)=0.105mol/L,c(Al3+)=0.055mol/L,c(H+)=0.01mol/L,则c(K+)为( )
A.0.045 mol/LB.0.035 mol/LC.0.055 mol/LD.0.040 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.50g锌投入100mL某浓度的盐酸中,锌和盐酸恰好完全反应.求:
(1)6.50g锌的物质的量;
(2)所用盐酸中HCl中的物质的量浓度;
(3)反应中生成的H2在标准状况下的体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液X中只可能含有K+、Mg2+、Al3+、AlO2—、SiO32—、SO32—、CO32—、SO42—中的若干种离子。某同学对该溶液X进行了如下实验;下列判断正确的是( )
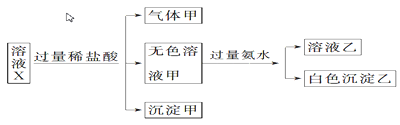
A. 气体甲一定是纯净物
B. K+、AlO2—和SiO32—一定存在于溶液X中
C. 沉淀甲是硅酸和硅酸镁的混合物
D. 凭以上实验能确定SO42—是否存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。现用该浓硫酸配制450mL 1mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。

请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有______(选填序号),还缺少的仪器有______(写仪器名称);
(2)经计算,配制上述稀硫酸时需要用量筒量取上述浓硫酸的体积为______mL(保留一位小数)。
(3)接下来的操作是将上述所取浓硫酸进行稀释,稀释的操作是________________、__________________。
(4)在溶液配制过程中,下列操作会引起所配置硫酸的浓度偏低的有_________(填序号)
A.用量筒量取浓硫酸读数时仰视刻度线;
B.转移稀释的硫酸溶液后未洗涤烧杯和玻璃棒;
C.浓硫酸稀释后未经冷却即转移到容量瓶中;
D.容量瓶未干燥就用来配置溶液;
E.定容后摇匀溶液,发现液面低于刻度线,再加入少量水使液面与刻度线相平;
F.定容时仰视刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验。
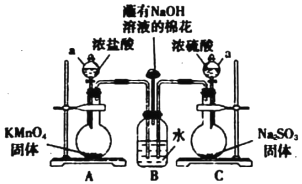
(1)图中仪器a的名称为_______。
(2)装置A中的反应为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,反应中的氧化剂是_____,生成71gCl2转移的电子是______mol。
(3)装置B中蘸有NaOH溶液的棉花的作用是______________。
(4)打开A、C装置a的活塞,一段时间后关闭活塞。待反应完全后.小组同学又继续做如下实验。
①甲同学取适量B中溶液于试管中,向其中滴加少量AgNO3溶液,有白色沉淀生成。甲同学由此认为SO2和Cl2,发生了反应,理由是该反应中生成了___________(填离子符号)。
②乙同学认为甲同学的结论不合理,认为A中生成的Cl2中混有杂质,应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法即可得到正确结论,乙同学认为Cl2中混有的杂质是_______,洗气瓶中盛有试剂的名称是____________。
③丙同学认为甲、乙两位同学的结论均不合理。丙同学取适量B中溶液于试管中,向其中滴加少量溶液X,有白色沉淀生成,得出结论即SO2与Cl2同时通入水中,可以发生反应。溶液X__________(填选项序号)。
a.BaCl2溶液 b.Ba(OH)2溶液 c.Ba(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 铜、石量均能导电,所以它们均是电解质
B. 蔗糖、酒精在水溶液和熔融状态下均不能导电,所以它们均是非电解质
C. 液态H2SO4、固体NaCl均不能导电,所以H2SO4、NaCl均是非电解质
D. NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3溶液加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
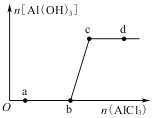
A. a点对应的溶液中:Na+、Fe3+、SO![]() 、HCO
、HCO![]()
B. b点对应的溶液中:Na+、S2-、SO![]() 、Cl-
、Cl-
C. c点对应的溶液中:Ag+、K+、NO![]() 、F-
、F-
D. d点对应的溶液中:K+、NH![]() 、I-、CO
、I-、CO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com