
【题目】由SiO2制备高纯度硅的工业流程如图所示:

下列说法错误的是
A. SiO2与纯硅都是硬度大、熔沸点高的晶体
B. X为CO气体
C. 反应②产生的H2与反应③产生的HCl可以循环使用
D. 反应①②③均为在高温条件下的非氧化还原反应
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】标出下列氧化还原反应的电子转移数目和方向,并写出氧化剂
(1)Al2(SO4)3+3H2 ![]() Al2O3 +3SO2 +3H2O 电子转移_______ 氧化剂是______
Al2O3 +3SO2 +3H2O 电子转移_______ 氧化剂是______
(2)6KMnO4 +5KI +3H2O= 6KOH+6MnO+5KIO3 电子转移_____________ 氧化剂是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 含有2NA个原子的氢气在标准状况下的体积约为44.8 L
B. 25 ℃,1.01×105 Pa,64 g SO2中含有的氧原子数为3NA
C. 40 g NaOH溶解在1 L水中,溶液中含Na+数为NA
D. 标准状况下,11.2 L H2O含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:

下列叙述错误的是
A. X、Y和Z均能使溴水褪色
B. X和Z均能与NaHCO3溶液反应放出CO2
C. Y既能发生取代反应,也能发生加成反应
D. Y可作加聚反应单体,X可作缩聚反应单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是
A. CaO+H2O=Ca(OH)2 B. 2NaOH+MgCl2=Mg(OH)2↓+2NaCl
C. SO2+H2O2=H2SO4 D. Cu(OH)2![]() CuO+H2O
CuO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F(  )为一种高分子树脂,其合成路线如下:
)为一种高分子树脂,其合成路线如下:
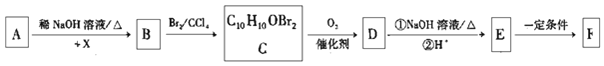
已知:①A为苯甲醛的同系物,分子中无甲基,其相对分子质量为134;

请回答下列问题:
(1)X的化学名称是__________。
(2)B生成C的反应类型为__________。
(3)E的结构简式为__________。
(4)由C生成D的化学方程式为__________。
(5)芳香族化合物Y是D的同系物,Y的同分异构体能与饱和Na2CO3溶液反应放出气体,分子中只有1个侧链,核磁共振氢谱显示有5种不同化学环境的氢,峰面积比为6:2:2:1:1。写出两种符合要求的Y的结构简式:__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时,生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作催化剂、杀菌剂等。
(1)将Na2SO3溶液逐滴加入到CuCl2溶液中,再加入少量浓盐酸混匀,得到CuCl沉淀。该反应中被氧化的物质是______(填化学式)。
(2)为测定制得CuCl样品的纯度,进行下列实验:a.称取0.5000 g样品,放入盛有 20 mL过量FeCl3溶液和玻璃珠的锥形瓶中,不断摇动;b.待样品溶解后,加水50 mL;c.立即用0.2000 mol·L-1 Ce(SO4)2标准溶液滴至反应完全,记录消耗标准溶液的体积; d.重复步骤a至c 2次,记录消耗标准溶液的平均体积为25.00 mL。
已知:CuCl + Fe3+ = Cu2+ + Fe2+ + Cl- Fe2+ + Ce4+ = Fe3+ + Ce3+
①配制100 mL 0.2000 mol·L-1 的Ce(SO4)2标准溶液时,需要的玻璃仪器除烧杯、量筒、玻璃棒、100 mL容量瓶外,还需要_______。
②通过计算确定该样品中CuCl的纯度。______
③进行步骤c时若操作缓慢,则测得CuCl的纯度_______(“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com