
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
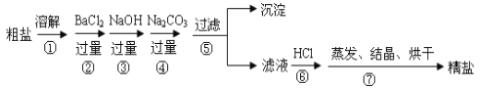
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是___________________________。
(2)第②步操作的目的是除去粗盐中的__________(填化学式),判断BaCl2已过量的方法是____________________________________________________________。
(3)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是________________。
(4)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、________、__________。
(5)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、酒精灯、火柴、玻璃棒、______。
(6)第④步除原食盐中杂质离子与碳酸根的反应外还有的反应的离子方程式为:______________________________;
(7)第⑥步操作中涉及反应的离子方程式有:__________________、__________________。
【答案】加速固体溶解 Na2SO4 或SO42- 取少量上层清液于试管中滴入几滴氯化钡溶液,若无白色沉淀生成则说明氯化钡已经过量 若用氢氧化钾会引入新的杂质氯化钾 CaCO3 Mg(OH)2、BaCO3 蒸发皿 CO32-+Ba2+==BaCO3↓ CO32-+2H+=H2O+CO2↑ OH-+H+=H2O
【解析】
实验流程为:粗盐样品含有Na2SO4、MgCl2、CaCl2等杂质,①加入过量的氯化钡,将硫酸根离子除去,引入钡离子杂质离子,②加入过量氢氧化钠溶液的目的是除去氯化镁,③加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2,⑤过滤,将得到的沉淀全部滤出,得到的滤液是含有氯化钠、碳酸钠、氢氧化钠等的混合物,⑥加入足量的盐酸,可以出去碳酸根离子、氢氧根离子等杂质离子,⑦最后即可获得较为纯净的氯化钠。
(1)粗盐溶解时通过玻璃杯的搅拌可以加速溶解;
(2)加入氯化钡溶液可除去杂质硫酸根离子;
(3)若用氢氧化钾溶液,会引进杂质钾离子;
(4)过滤可把溶液和不溶于水的物质除去,可以除去硫酸钡、碳酸钙、碳酸镁、碳酸钡和泥沙等不溶性杂质;
(5)根据蒸发操作方法判断使用的仪器及缺少的仪器;
(6)碳酸钠与氯化钡、氯化钙反应分步生成碳酸钡和碳酸钙沉淀,据此写出反应的化学方程式;
(7)第⑥步用盐酸中和碳酸钠、氢氧化钠.
实验流程为:粗盐样品含有Na2SO4、MgCl2、CaCl2等杂质,①加入过量的氯化钡,将硫酸根离子除去,引入钡离子杂质离子,②加入过量氢氧化钠溶液的目的是除去氯化镁,③加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2,⑤过滤,将得到的沉淀全部滤出,得到的滤液是含有氯化钠、碳酸钠、氢氧化钠等的混合物,⑥加入足量的盐酸,可以出去碳酸根离子、氢氧根离子等杂质离子,⑦最后即可获得较为纯净的氯化钠。
(1)第①步粗盐溶解操作中用玻璃棒搅拌,可加速粗盐的溶解;
(2)加入氯化钡溶液可以除去杂质Na2SO4或硫酸根离子;继续加入氯化钡溶液,若无沉淀生成,则说明氯化钡已经过量,所以判断BaCl2已过量的方法是:取少量上层清液与试管中加入氯化钡溶液,若白色沉淀生成则氯化钡已经过量;
(3)提纯的是氯化钠,若用氢氧化钾会引入新的杂质氯化钾;
(4)通过过滤可把溶液中的不溶物除去,则可以除去的物质有泥沙、BaSO4、Mg(OH)2、BaCO3;CaCO3;
(5)根据“蒸发结晶”的步骤可知,蒸发过程用到的仪器有:铁架台(铁圈)、坩埚钳、石棉网、火柴、玻璃棒、酒精灯、蒸发皿,缺少蒸发皿;
(6)第④步加入碳酸钠,碳酸钠与氯化钡、氯化钙反应生成碳酸钙和碳酸钡沉淀,反应的化学方程式为:Na2CO3+BaCl2=BaCO3+2NaCl、Na2CO3+CaCl2=CaCO3+2NaCl,第④步除原食盐中杂质离子与碳酸根的反应外还有的反应的离子方程式为:CO32-+Ba2+==BaCO3↓ ;
(7)第⑥步加入盐酸的目的是除去过量的碳酸钠和氢氧化钠,反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2、NaOH+HCl=NaCl+H2O,第⑥步操作中涉及反应的离子方程式有:CO32-+2H+=H2O+CO2↑ 、OH-+H+=H2O。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
【题目】“空气吹出法”海水提溴的工艺流程如下:
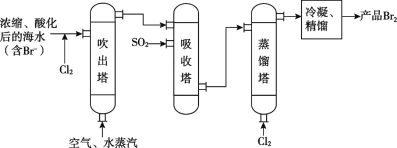
下列说法中,不正确的是
A. 实验室保存溴通常加少量水
B. 海水提溴与海水提镁发生的所有反应均为氧化还原反应
C. 经过吸收塔后,溴元素得到了富集
D. 蒸馏塔中还发生了化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:
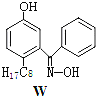
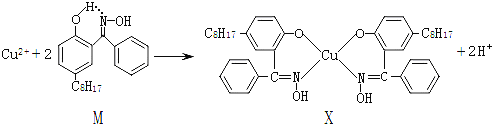
(1)关于M所含元素的说法正确的是______________。
A.电负性由大到小顺序:O>N>C>H
B.第一电离能由大到小的顺序:O>N>C
C.氮原子以sp2杂化轨道与氧原子形成σ键
D.从物质分类角度M属于芳香烃,M中所有的碳原子不可能共面
E.组成M元素的氢化物稳定性:CH4<H2O<NH3
(2)上述反应中断裂和生成的化学键有_______(填序号)。
A.氢键 B.配位键 C.金属键 D.范德华力 E.共价键 F.离子键
(3)M与W(分子结构如上图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_______________。
(4)基态Cu2+的外围电子排布图为________________,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是_____________________________________________________________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(5)已知:Y原子最高价氧化物对应水化物的酸性最强。铜与Y形成化合物的晶胞如附图所示(黑点代表铜原子,空心圆代表Y原子)。
①该晶体的化学式为_______________。(用元素符号表示)
②已知铜和Y原子的电负性分别为1.9和3.0,则铜与Y原子形成的化合物属于____________(填“离子”或“共价”)化合物。
③已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子与Y原子之间的最短距离为_______________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①R—Br―→R—OH(R表示烃基);
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响;
以下是用苯作为原料制备一系列化合物的转化关系图:
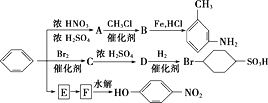
(1)写出A转化为B的化学方程式:______________________。
(2)图中苯转化为E,E转化为F省略了条件,请写出E、F的结构简式:
E________________,F_____________________。
(3)B分子中苯环上的任意两个氢被溴原子取代后,得到的二溴代物有____种同分异构体。
(4)上述转化中涉及到9个反应,其中不属于取代反应的共有_____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)从1L1mol/LNaOH溶液中取出100mL,则这100mLNaOH溶液的物质的量浓度是____mol/L,含NaOH的质量____g。
(2)某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,该HCl气体的物质的量为______,可知所配成的盐酸溶液的物质的量浓度为_____。
(3)在标准状况下15gCO与CO2的混合气体,体积为11.2L。则:
①混合气体的密度是_____。
②混合气体的平均摩尔质量是______。
③CO2和CO的体积之比是_______。
④CO的体积分数是______。
⑤CO2和CO的质量之比是_______。
⑥CO的质量分数是______。
⑦混合气体中所含氧原子的物质的量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列无色溶液中的离子能大量共存的是( )
A.H+、K+、OH-、Cl-B.Na+、Cu2+、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl-D.Ba2+、K+、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )

①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu+2e-=Cu2+,发生氧化反应
A. ①②③B. ②④⑥
C. ②④D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁片放入下列溶液中,反应时无气体放出,取出后铁片质量减轻,则该溶液是( )
A. 稀硫酸 B. CuSO4 C. AgNO3 D. Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列判断正确的是
A. 常温下,pH=1的盐酸溶液中,由水电离的H+个数为10-13NA
B. 标准状况下,氧原子总数为0.2NA的CO2和NO2的混合气体,其体积为2.24L
C. 常温下,5.6g铁分别与足量氯气和浓硝酸反应,转移的电子数目均为0.3NA
D. 100g46%(质量分数)乙醇溶液中所含O-H数目为7NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com